
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
| A.热裂解形成燃油 | B.露天焚烧 | C.作为有机复合建筑材料的原料 | D.直接填埋 |

| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率(×10-3 mol·L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
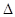 H
H
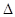 H,
H,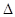 H= 。
H= 。(1)BD
(2)Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68kJ.mol-1
(3)H2O2分解速率加快
(4)2Cu2++SO32-+2Cl-+H2O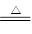 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
(5)△H1+3△H2+18△H3
(6)4FeS2(s)+11O2(g)=8SO2(g)+2Fe2O3(s) ΔH=-3 408 kJ·mol-1
解析试题分析:(1)露天焚烧产生有毒气体,污染空气;直接填埋使重金属离子污染土壤和地下水;
(2)-285.84-196.46/2+64.39=-319.68KJ/mol;
(3)H2O2分解速率加快,使其在氧化铜之前就分解为氧气和水;
(4)二价铜离子把四价硫离子氧化为六价,自身被还原为一价;
(5)根据化学方程式的加减得出;
(6)完全燃烧后的产物为稳定的产物。
考点:热化学反应方程式的书写、反应热的计算。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
(1)已知反应及几种物质中化学键断裂时的能量变化如下所示:
H2(g)+Cl2(g)=2HCl(g) △H=-184kJ/mol
4HCl (g)+O2(g)=2Cl2 (g) +2H2O (g) △H=-115.6kJ/mol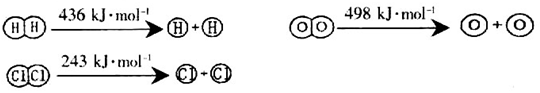
①H2与O2反应生成气态水的热化学方程式为_________________________________;
②断开1mol H—O键所需能量约为_________________________kJ。
(2)已知某反应的平衡常数表达式为:K= ,它所对应的化学方程式为________________。
,它所对应的化学方程式为________________。
(3)已知反应N2(g)+3H2(g) 2NH3(g) △H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。
2NH3(g) △H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。
A.缩小体积增大压强 B.升高温度
C.加催化剂 D.使氨气液化移走
(4)在一定体积的密闭容器中进行如下化学反应:A(g)+3B(g) 2C(g)+D(s) △H,其化学平衡常数K与T的关系如下表:
2C(g)+D(s) △H,其化学平衡常数K与T的关系如下表:
| T/K | 300 | 400 | 500 | …… |
| K/(mol·L-1)2 | 4×106 | 8×107 | 1.2×109 | …… |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量。试写出液态CH3OH燃烧热的热化学方程式 。
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
| 化学键 | H—H | N—H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二甲醚(CH3OCH3,沸点为-24.9℃)被称为21世纪的新型能源。科学家利用太阳能分解水生成的氢气与从烟道气中分离出的CO2在催化剂作用下合成二甲醚,并开发出直接以二甲醚为燃料的燃料电池。其合成流程如下:
(1)已知:CH3OCH3(g)、H2(g)的标准燃烧热分别为:△H= -1455.0kJ·mol-1、△H=" -285.8" kJ·mol-1。写出以CO2、H2合成CH3OCH3的热化学方程式: ;
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。写出吸收CO2反应的化学方程式 ;
(3)一定条件下用CO2和H2合成二甲醚,反应物气流量对CO2的转化率、二甲醚的选择性(是指转化生成二甲醚的碳占已转化碳的比例)影响结果如图1所示,当控制气流量为28mL· min-1时,则生成0.3mol二甲醚需要通入CO2的物质的量为 ;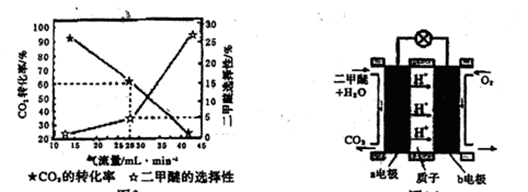
图1 图2
(4)图2为二甲醚燃料电池示意图。
①a电极的电极反应式为 ;
②若以1.12 L·min-l(标准状况)的速率向该电池中通入二甲醚,用该电池电解50mL2 mol·L-1 CuSO4溶液,通电0.50 min后,计算理论上可析出金属铜的质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实。
已知:①CH3CH2OH(l) +3 O2 (g) = 2CO2(g) +3H2O(l) △H=-1366.8 kJ/ mol
②2H2 (g) + O2 (g) = 2H2O(l) △H=" -571.6" kJ/ mol
(1)写出由CO2和H2 反应合成CH3CH2OH (l)和H2O(l)的热化学方程式 。
(2)碱性乙醇燃料电池易储存,易推广,对环境污染小,具有非常广阔的发展前景。该燃料电池中,使用铂作电极,KOH溶液做电解质溶液。请写出该燃料电池负极上的电极反应式为 。
(3)用乙醇燃料电池电解400 mL 饱和食盐水装置可简单表示如下图: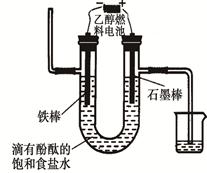
该装置中发生电解反应的方程式为 ;在铁棒附近观察到的现象是 ;当阴极产生448 mL气体(体积在标准状况下测得)时,停止电解,将电解后的溶液混合均匀,溶液的pH为 。(不考虑气体的溶解及溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。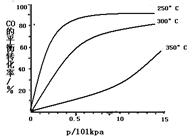
(1)NO2可用水吸收,相应的化学反应方程式为 。
利用反应6NO2+ 8NH3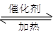 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol
2NO2(g) ΔH="-113.0" kJ·mol
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
该温度下,此反应的平衡常数表达式K= 。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ、下列实验操作或对实验事实的描述正确的是____________________
① 用量筒量取稀硫酸溶液8.0mL;
②中和热的测定实验中,可用金属丝(棒)代替环形搅拌玻璃棒;
③用热的浓盐酸洗涤附着有MnO2的试管;
④在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ;
⑤Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离;
⑥用碱式滴定管量取KMnO4溶液20.50mL ;
⑦将水沿烧杯内壁缓缓注入浓硫酸中,不断用玻璃棒搅拌以稀释浓硫酸;
⑧用湿润的pH试纸测量某溶液pH时,测量值一定比真实值小;
⑨锌和一定量稀硫酸反应,为加快速率而不影响H2的量可向溶液中加适量Cu(NO3)2晶体。
Ⅱ、2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。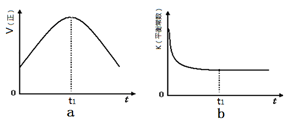
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
②2NO2(g)  N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
③H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)家用液化石油气的主要成分之一是丁烷(C4H10),当10 kg丁烷完全燃烧并生成二氧化碳气体和液态水时,放出的热量为5×105 kJ。试写出丁烷燃烧的热化学方程式: 。已知1mol液态水汽化时需要吸收44 kJ热量,则反应C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(g)的ΔH= 。
(2)有同学用丁烷与空气为原料制作一燃烧电池,通入丁烷的一极为 极。若以稀硫酸为电解质溶液时,其正极反应式为 。
(3)已知:Fe(s) +1/2O2(g)=FeO(s) ΔH=-272.0kJ·mol-1
2Al(s)+3/2O2(g)=Al2O3(s) ΔH=-1675.7kJ·mol-1
Al和FeO发生铝热反应的热化学方程式是 。
(4)已知拆开1 mol H-H键,1 molN-H键,1 molN≡N键分别需要的能量是akJ、bkJ、ckJ,则N2与H2反应生成NH3的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g)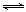 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程)。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程)。
(2)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:N2(g)+ O2(g) = 2NO(g) △H = +180.5kJ/mol
2H2(g)+ O2(g) = 2H2O(l) △H = -571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为 。
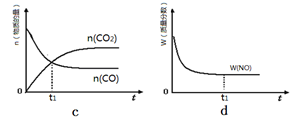
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率。右图是反应:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H 0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H 0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。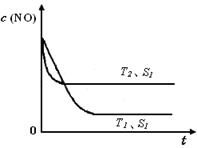
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com