
已知气体的摩尔质量越小,扩散速度越快。下图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是( )

A.甲是浓氨水,乙是浓硫酸 B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓盐酸 D.甲是浓硝酸,乙是浓氨水
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重 要的应用。
要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) △H1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)=CaSiO3(s) △H2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=6CaSiO3(s)+P4(s)+10CO(g) △H3
则△H3= kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如右图所示。
①为获得尽可能纯的NaH2PO4,pH应控制在 ;pH=8时,溶液中主要含磷物种浓度大小关系为 。
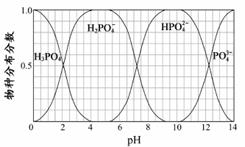
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是
(用离子方程式表示)。
(4)磷的化合物三氯氧磷( )与季戊四醇(
)与季戊四醇(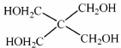 )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如下图所示。
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如下图所示。
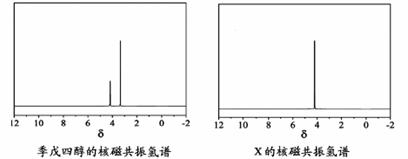
①酸性气体是 (填化学式)。
②X的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
请回答下列问题:
(1)组成单质A的元素位于周期表中第 周期,第 族。
(2)B与氢氧化钠溶液反应的化学方程式为: 。
(3)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为 ,当生成2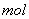 二氧化氯时,转移电子
二氧化氯时,转移电子 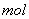 。
。
(4)溶液F在空气中长期放置生成H的化学反应方程式为: 。
(5)H的溶液与稀硫酸反应产生的现象为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl下标5 |
| 沸点/℃ | 57.7 | 12.8 | — | 315 | — |
| 熔点/℃ | -70.0 | -107.2 | — | — | — |
| 升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式____________。
(2)装置A中g管的作用是____________;装置C中的试剂是;装置E中的h瓶需要冷却的理由是____________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO-4+8H+====5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由__________________。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1)如图是离子交换膜法电解饱和食盐水示意图。电解槽阳极产生的气体是____________;NaOH溶液的出口为___________(填字母);精制饱和食盐水的进口为___________(填字 母);干燥塔中应使用的液体是___________。
母);干燥塔中应使用的液体是___________。
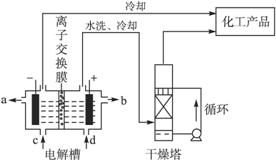
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为____________________________________________。
②SiCl4可转化为SiHCl3而循环使用。一定条件下,在20 L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2和SiHCl3物质的量浓度分别为0.140 mol/L和0.020 mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为___________kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气。现制得氯酸钠213.0 kg,则生成氢气_________m3(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质①乙烷 ②乙炔
③甲苯 ④苯 ⑤聚乙烯 ⑥对苯二酚 ⑦溴乙烷 ⑧葡萄糖,其中既能与溴水反应又能与酸性高锰酸钾溶液反应的是( )
A.②③④⑤⑧ B.②③④⑥⑦⑧
C.②⑥⑧ D.②⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于用比色法测定自制硫酸亚铁铵的纯度的说法正确的是( )
A.配制标准色阶使用的滴定管是碱式滴定管
B.在不同级别的标准色阶中Fe3+浓度差别越大,测定的硫酸亚铁铵的纯度误差越小
C.配制标准色阶时,加入一定量的盐酸的目的是抑制Fe3+的水解
D.用待测产品溶液与标准色阶比较,可以准确确定产品纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
目前,关于二氧化碳是否为大气污染物有不同的观点。认为“二氧化碳不是大气污染物”的理由是( )。
①二氧化碳是重要的化工原料
②二氧化碳是植物光合作用的必需原料
③二氧化碳是无色、无味、无毒的气体
④除二氧化碳外,甲烷、一氧化二氮也是温室气体
A.①② B.②③
C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
.将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b L(气体体积均在同温同压下测定),该b L气体中NH3的体积分数是
A.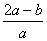 B.
B.
C. 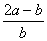 D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com