
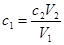 ,其中
,其中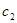 、
、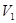 是不变的,然后根据具体的操作分析
是不变的,然后根据具体的操作分析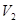 的变化。
的变化。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.硝酸为弱电解质 |
| B.该溶液1 mL稀释至100 mL后,pH小于3 |
| C.向该溶液中加入等体积、等浓度的氢氧化钡溶液,混合后溶液pH=7 |
| D.该溶液中水电离出的c(H+)=1×10-13 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.④>③>①=⑤>② | B.①=②>③>④>⑤ | C.②>①>③>④>⑤ | D.④>③>①>⑤>② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | A | B | C | D |
| c(X)/mol·L-1 | 0.035 | 0.070 | 0.03 | 0.06 |
| c(Y)/mol·L-1 | 0.070 | 0.035 | 0.06 | 0.03 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=8的某电解质的溶液 | B.c(OH-)>1×10-7mol/L |
| C.溶液中含有OH- | D.溶液中c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 |
| B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定 |
| C.用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,加入少量的蒸馏水再进行滴定 |
| D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com