
����Ŀ������������������Һ���й���������ȷ���ǣ�������
�� | �� | �� | �� | |
Ũ��c/mol/L | 0.1 | 0.1 | 0.1 | 0.1 |
��Һ | ��ˮ | CH3COONa��Һ | ���� | ���� |
A.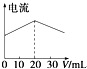 ��20 mL ����Һ����μ������Һ����Һ���������仯��ͼ
��20 mL ����Һ����μ������Һ����Һ���������仯��ͼ
B.�ڡ�������Һ�������ϣ�����Ũ�ȣ�2c��Na+��=c��CH3COO����+c��CH3COOH��
C.�١�������Һ�������ϣ�����Ũ�ȣ�c��Cl������c��NH4+����c��H+����c��OH����
D.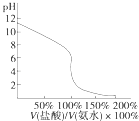 �âܵζ��٣��ζ�������ͼ�����÷�̪��ָʾ��
�âܵζ��٣��ζ�������ͼ�����÷�̪��ָʾ��
���𰸡�D
���������⣺A��һˮ�ϰ��ʹ�����������ʣ�����Ⱥ�С���䷴Ӧ���ɵĴ������ǿ����ʣ��ܹ���ȫ���룬�����ƶ�������Ũ�ȴ���Һ��������ǿ���������Ϻ��ٵ�����ᣬ����Ũ�ȼ�С������������������A��ȷ��
B���������غ㣬�ڡ�������Һ�������ϣ�����Ũ�ȣ�2c��Na+��=c��CH3COO����+c��CH3COOH������B��ȷ��
C���١�������Һ�������������Ȼ����Һ���Ȼ����Һ��笠�����ˮ��ʹ��Һ�����ԣ�����������Ũ��c��Cl������c��NH4+����c��H+����c��OH��������C��ȷ��
D��ǿ������������к͵ζ�ʱ�ü�����ָʾ������D����
��ѡD��
�����㾫����������Ҫ���������������ˮ��Һ�еĵ���ƽ������֪ʶ�㣬��Ҫ���յ�������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ��������ȷ�����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����5�֣���50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ�
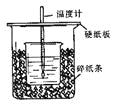
�ش��������⣺
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ�� ��
��2���ձ���������ֽ���������� ��
��3�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ (����ƫ��ƫС����Ӱ����)
��4�������60mL0.50mol/L������50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������� (������ȡ��������)�������к��� (������ȡ��������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�������ϡ�����AlCl3��Һ����μ�������İ�ˮ����Һ�ʼ��ԣ�����ͼ�У��ܱ�ʾ�÷�Ӧ�����ij���������W����백ˮ�����V��ϵ���ǣ�������
A.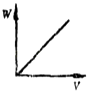
B.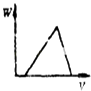
C.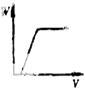
D.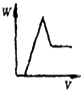
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ������·���ѩ�����dz�ʹ��һ����ѩ��������Ҫ�ɷֵĻ�ѧʽΪXY2��X��Y��Ϊ���ڱ�ǰ20��Ԫ�أ��������Ӻ������ӵĵ��Ӳ�ṹ��ͬ����1 mol XY2����54 mol ���ӡ�
(1)����ѩ���Ļ�ѧʽ��________���������л�ѧ��������________������ʽ��________________��
(2)Ԫ��D��Eԭ�ӵ�����������������Ӳ�����2����D��Y���ڣ���D�����ӽṹʾ��ͼ��____________��D��E���γ�һ�ֽṹ������CO2����ԭ�ӷ��ӣ���ÿ��ԭ�Ӷ��ﵽ��8e���ȶ��ṹ���÷��ӵĵ���ʽΪ____________����ѧ������Ϊ________________(����Ӽ��������Ǽ��Թ��ۼ������Թ��ۼ���)��
(3)W����Dͬ����Ķ�����Ԫ�أ�Z�ǵ������ڽ�������ǿ��Ԫ�أ�Z�ĵ�����W�ij��������з�Ӧʱ�����ֲ��������ʱ����________���仯ѧ������Ϊ________������ʱ����________���仯ѧ������Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
A. ����C��H��O����Ԫ�� B. �����������C��H��O�ı�����1:2:1
C. �ǿɷ�Ϊ���ǡ����ǡ��������� D. �������������Ҫ��Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ������ ��
A. ���Ȼ�����Һ�м��������ˮ��Al3++4NH3��H2O=4AlO2-+4NH4++2H2O
B. ����������ϡ���ᷴӦ��������S2-+2H+=H2S��
C. ˫��ˮ�м���ϡ�����KI��Һ��H2O2+2H++2I-=I2+2H2O
D. ��NH4HCO3��Һ�мӹ�����NaOH��Һ��������NH4++OH-![]() NH3��+H2O
NH3��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ�����Դ���Ź㷺��Ӧ��ǰ����������Ȼ���Ʊ��������������¡�
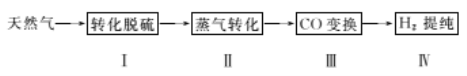
��ش��������⣺
I��ת��������Ȼ��ѹ����������30��ʱ����T��F�������£����Ի������������ʾ��ͼ���¡�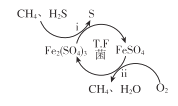
(1)����i��H2S������ ___��ѡ���������ԭ������Ӧ��
(2)���̢������ӷ���ʽ��____��
(3)��֪����Fe3+��pH=l.9ʱ��ʼ������pH=3.2ʱ������ȫ��
��30��ʱ����T.F�������£���ͬpH��FeS04��Һ��Fe2+�������������±���
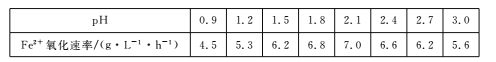
����������Ϣ���жϹ�ҵ����Ӧѡ������pH��Χ����˵��ԭ��____��
������ת�����ڴ����������£�ˮ������CH4�����������ͼ�ش����⡣
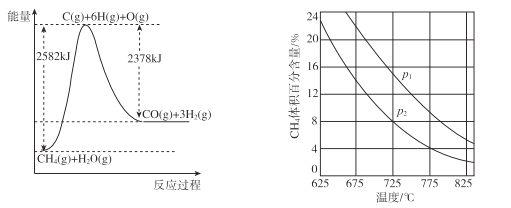
(4)�ٸù��̵��Ȼ�ѧ����ʽ��____��
�ڱȽ�ѹǿP1��p2�Ĵ�С��ϵ��p1 __ p2��ѡ�>����<����=������
��CO�任��500��ʱ��CO��һ����ˮ��Ӧ����CO2��H2��
����H2�ᴿ����CO2��H2����õ�H2�Ĺ���ʾ��ͼ���¡�
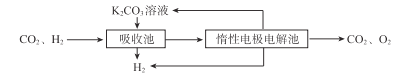
(5)�����ճ��з�����Ӧ�����ӷ���ʽ�� ___��
�ڽ�ϵ缫��Ӧʽ������K2CO3��Һ������ԭ����____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2����Ҫ������Ⱦ��֮һ����ҵ�Ͽ�������װ������ת��SO2(A��BΪ���Ե缫)������˵����ȷ����

A. ��������������B��b��a��A
B. a��A���Ͼ�����������Ӧ
C. ���ӽ���ĤΪ�����ӽ���Ĥ
D. B���ϵĵ缫��ӦʽΪ��SO2+2e��+2H2O=SO42-+4H+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com