
【题目】图中,表示2A(g)+B(g)2C(g)(正反应放热).这个可逆反应的正确图象是( )
A.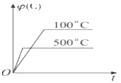
B.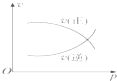
C.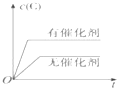
D.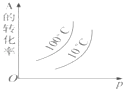
【答案】A
【解析】解:A.温度高反应速率加快,到达平衡时间缩短,正反应为放热反应,升高温度平衡逆向移动,C的体积分数减小,图象与实际相符合,故A正确;
B.交点前未到达平衡,压强增大平衡正向进行,交点处于平衡状态,再增大压强平衡向气体体积减小的方向移动,但瞬间正逆速率均增大,图象与实际不相符,故B错误;
C.使用催化剂加快反应速率,缩短到达平衡的水解,但使用催化剂不影响平衡移动,C的浓度不变,图象与实际不相符,故C错误;
D.正反应为放热反应,升高温度平衡逆向移动,A的转化率减小,正反应为气体体积减小反应,增大压强平衡正向移动,A的转化率增大,图象与实际不相符,故D错误,
故选:A.
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】根据元素周期律的知识,下列两者性质比较中,不正确的是
A. 热稳定性:PH3<NH3 B. 金属性强弱:Na>Mg>Al
C. 酸性强弱:HF>HCl>HBr>HI D. 原子半径:K>Si>Cl>F
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类组合正确的是
A | B | C | D | |
纯净物 | 空气 | NaOH | 稀盐酸 | FeSO4·7H2O |
非电解质 | H2O | Na2O | CO | NH3 |
电解质 | HNO3 | Cu | 蔗糖 | CH3COOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关图像如下所示:


请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的离子有____________________。
(2)实验③中所发生反应的离子反应方程式为___________________________。
(3)依据图2判断出的原溶液中阳离子的种类及物质的量的比值为________。
(4)原溶液中NO3-是否存在?________ (“存在”、“不存在”或“不确定”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能够大量共存的是
A. H+、SO42― 、 SO32― B. Ba2+、 CO32―、N O3―
C. Na+、Cl一、SO42― D. Ca2+、SO42―、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2A(g)+B(g)3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )
A.v(A)=0.7 mol/(L.min)
B.v(B)=0.3mol/(L.min)
C.v(C)=0.9 mol/(L.min)
D.v(D)=1.1mol/(L.min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.具有相同通式的有机物不一定互为同系物
B.分子组成相差一个或若干个CH2原子团的化合物不一定互为同系物
C.所有的烷烃之间一定互为同系物
D.两个相邻同系物的相对分子质量数值一定相差14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4 , 发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
(1)反应的△H0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示.在0~60s时段,反应速率v(N2O4)为molL﹣1s﹣1反应的平衡常数K1= . 
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL﹣1s﹣1的平均速率降低,经10s又达到平衡.
①T100℃(填“大于”“小于”),判断理由是
②温度T时反应的平衡常数K2=
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向(填“正反应”或“逆反应”)方向移动,判断的理由是: .
(4)综合(1)、(2)小题信息你得出温度对平衡常数的影响规律是: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com