
【题目】设NA代表阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,22.4 L CO和C2H4混合气体的总分子数为2NA,质量为28 g
B. 常温常压下,1 mol甲基(-CH3)所含电子数为9NA
C. 1 L 0.1 mol/L (NH4)2SO4溶液中含NH4+离子数为0.2NA
D. 用惰性电极电解饱和食盐水,当两极共收集到气体4.48L时,外电路中转移电子数为0.2 NA
【答案】B
【解析】A项,标准状况下,22.4 L CO和C2H4混合气体为1mol,分子数为NA,故A错误;B项,1个C电子数为6,1个氢原子电子数为1,所以1 mol甲基(-CH3)中所含电子数为9NA,B正确;C项,(NH4)2SO4溶液中存在铵根离子的水解,所以1 L 0.1 mol/L (NH4)2SO4溶液中含NH4+离子数小于0.2NA,C错误;D项,电解饱和食盐水若只得到氢气、氯气和氢氧化钠,其离子方程式为:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-;标况下4.48L气体的物质的量的为0.2mol,根据电解离子方程式可知,生成了0.1molH2和0.1mol Cl2,转移电子为0.2mol,如果NaCl不足,后期会电解水,产生氢气和氧气,则转移电子不是0.2mol,故D错误。
H2↑+Cl2↑+2OH-;标况下4.48L气体的物质的量的为0.2mol,根据电解离子方程式可知,生成了0.1molH2和0.1mol Cl2,转移电子为0.2mol,如果NaCl不足,后期会电解水,产生氢气和氧气,则转移电子不是0.2mol,故D错误。


科目:高中化学 来源: 题型:
【题目】现有ag某气体,它由双原子分子构成,它的摩尔质量为Mg/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为_________mol。
(2)该气体所含原子总数为_____________个。
(3)该气体在标准状况下的体积为___________L。
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为_____________。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为___________mol/L。
(6)下列所含分子数由多到少的排列顺序是____________(填写序号)。
A.标准状况下33. 6 L H2 B.所含电子的物质的量为4 mol的H2
C. 4℃时45 g H2O D.常温下,16gO2与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)![]() 2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下∶
2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下∶
容器 | 甲 | 乙 | 丙 |
反应物的投入量 | 3 molH2、2 molN2 | 6 molH2、4 molN2 | 2 molNH3 |
达到平衡的时间/min | 5 | 8 | |
平衡时N2的浓度/ mol·L-1 | c1 | 1.5 | |
NH3的体积分数 | φ1 | φ2 | |
混合气体的密度/g·L-1 | ρ1 | ρ2 |
下列说法不正确的是
A.容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol·L-1·min-1
B.在该温度下甲容器中反应的平衡常数K=![]()
C.2c1<1.5
D.2ρ1=ρ2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下图为相互串联的三个装置,试回答:
![]()

(1)若利用乙池在铁片上镀银,则B是_________(填电极材料),电极反应式是_________;应选用的电解质溶液是_____________。
(2)若利用乙池进行粗铜的电解精炼,则________极(填“A”或“B”)是粗铜,若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为_____________________。
(3)丙池滴入少量酚酞试液,电解一段时间___________(填“C”或“Fe”)极附近呈红色。
(4)写出甲池负极的电极反应式:________________________________。若甲池消耗3.2gCH3OH气体,则丙池中阳极上放出的气体物质的量为______________。
II.(5)请利用反应Fe +2Fe3+= 3Fe2+设计原电池。
设计要求:①该装置尽可能提高化学能转化为电能的效率;
②材料及电解质溶液自选,在图中做必要标注;
③画出电子的转移方向。____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
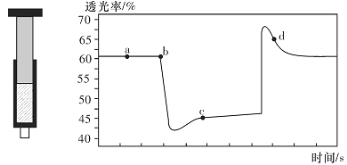
A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.d 点:v(正)>v(逆)
D.若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了避免青铜器生成铜绿,以下方法正确的是 ( )
A.将青铜器放在银质托盘上B.将青铜器与直流电源的正极相连
C.将青铜器保存在潮湿的空气中D.在青铜器的表面覆盖一层防渗的高分子膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590 ℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足8电子稳定结构
B.P4和CH4都是正四面体形分子且键角都为109°28′
C.NH4+的电子式为 ,离子呈平面正方形结构
,离子呈平面正方形结构
D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com