
【题目】金属钒(V)及其化合物有着广泛的用途。请回答下列问题:
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图1所示。V2O74-中V元素的化合价是________,溶液中VO3-转化为V2O74-的离子方程式为________。
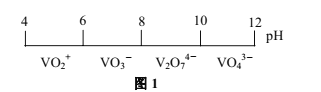
(2)偏钒酸铵是最普通的钒酸盐,将V2O5溶于碳酸钠溶液中(有气体生成),然后加入氯化铵,便可析出偏钒酸铵(NH4VO3),该过程总反应的化学方程式为________;当pH超过8.0时偏钒酸铵会发生转化,其原因是溶液中的VO3-转化为V2O74-、________(请另写出一点原因)。
(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g)![]() 2SO3(g)ΔH=pkJ/mol反应的催化剂,其催化原理如图2所示。
2SO3(g)ΔH=pkJ/mol反应的催化剂,其催化原理如图2所示。
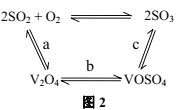
①过程a和过程b的热化学方程式为
V2O5(s)+SO2(g)=V2O4(s)+SO3(g) ΔH=qkJ/mol
V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) ΔH=rkJ/mol
则过程c的热化学方程式为_________。
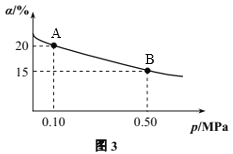
②T℃时反应2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0中SO3的转化率(α)与体系总压强(p)的关系如图3所示。T℃时,将2molSO3置于10L密闭容器中,反应达到平衡后,体系总压强为0.10MPa。则T℃时B点的化学平衡常数Kc=_________。
2SO2(g)+O2(g) ΔH>0中SO3的转化率(α)与体系总压强(p)的关系如图3所示。T℃时,将2molSO3置于10L密闭容器中,反应达到平衡后,体系总压强为0.10MPa。则T℃时B点的化学平衡常数Kc=_________。
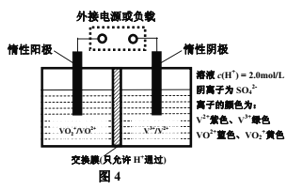
(4)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图4所示。
①充电过程中,右槽溶液颜色逐渐由________色变为________色;
②充电时若转移的电子数为NA个,则左槽溶液中n(H+)的变化量为______。
【答案】+5 2VO3-+2OH-=V2O74-+H2O V2O5+Na2CO3+2NH4Cl=2NH4VO3+2NaCl+CO2↑ pH过大,溶液中的NH4+会转化为NH3·H2O 2VOSO4(s)=V2O5(s)+SO3(g)+SO2(g) △H=(p-q-r)kJ/mol 0.00125 绿 紫 1mol
【解析】
(1)根据化合物中元素化合价代数和等于0分析判断,根据图示,在碱性溶液中VO3-转化为V2O74-;
(2)V2O5、Na2CO3、NH4Cl混合发生反应产生NH4VO3、CO2气体及NaCl,据此书写反应方程式;根据NH4+与OH-不能大量共存分析;
(3)①根据盖斯定律,将已知的热化学方程式叠加,可得待求反应的热化学方程式;
②SO3的平衡转化率为20%,则反应的三氧化硫为0.4mol,根据三段式计算平衡时各组分物质的量浓度,根据平衡压强,结合气体的物质的量、计算平衡浓度,带入平衡常数表达式K=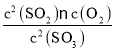 计算平衡常数;
计算平衡常数;
(4)充电时阳极发生氧化反应,阴极发生还原反应,根据不同价态离子的颜色判断;
(1)O元素化合价为-2价,则在V2O74-中V元素的化合价是(2×7-4)÷2=+5价;根据图示,在碱性溶液中VO3-转化为V2O74-,转化的离子方程式是2VO3-+2OH-=V2O74-+H2O;
(2)V2O5、Na2CO3、NH4Cl混合发生反应产生NH4VO3、CO2及NaCl,反应方程式为:V2O5+Na2CO3+2NH4Cl=2NH4VO3+2NaCl+CO2↑;根据图示可知:当溶液pH在8~10时, VO3-转化为V2O74-,同时溶液中的NH4+与OH-会发生反应,转化为弱电解质NH3·H2O;
(3)①(i)2SO2(g)+O2(g)![]() 2SO3(g)△H=pkJ/mol
2SO3(g)△H=pkJ/mol
(ii)V2O5(s)+SO2(g)=V2O4(s)+SO3(g) ΔH=qkJ/mol
(iii)V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) ΔH=rkJ/mol
根据盖斯定律,①-②-③得过程iii的反应为:2VOSO4(s)=V2O5(s)+SO3(g)+SO2(g),△H=(p-q-r)kJ/mol;
②T℃时,将2molSO3置于10L密闭容器中,反应开始时,c(SO3)=2mol÷10L=0.2mol/L,反应达到平衡后,体系总压强为0.10MPa,此时SO3的平衡转化率为20%,则反应的三氧化硫的物质的量n(SO3)=2mol×20%=0.4mol,容器体积为10L,则△c(SO3)=0.4mol÷10L=0.04mol/L,平衡时c(SO3)=0.2mol/L-0.04mol/L=0.16mol/L,c(SO2)=0.04mol/L,c(O2)=0.02mol/L,则该反应的化学平衡常数K=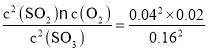 mol/L=0.00125mol/L
mol/L=0.00125mol/L
(4)①在充电时,右侧阴极上发生还原反应,V3+获得电子变为V2+,右侧会看到溶液由绿色变为紫色;
②充电时右侧发生还原反应:V3++e-=V2+,每转移1mol电子,右侧正电荷数目减少NA个,所以转移的电子数为NA个,溶液中H+会通过质子交换膜由左侧进入右侧,则左槽n(H+)的变化量为1mol。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某药物丙可由有机物甲和乙在一定条件下反应制得:
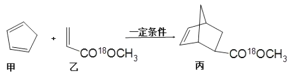
下列说法正确的是
A.丙在碱性条件下水解生成 和CH318OH
和CH318OH
B.甲分子中所有原子共平面
C.乙的化学式是C4H518OO
D.甲与乙生成丙的反应属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
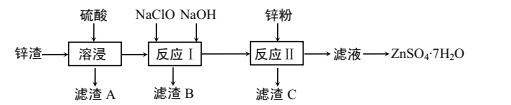
(1)“溶浸”操作中,选用“锌渣”而不选择氧化锌矿粉的原因是______;该操作中不断通入高温水蒸气的目的是________。
(2)“滤渣A”的主要成分是________。
(3)“反应Ⅰ”中,加入NaClO反应的离子方程式为___。
(4)“反应Ⅰ”中,再加入NaOH调节pH约为4.5,则“滤渣B”的主要成分是_____(填化学式)。(Ksp[Zn(OH)2]=3×10-17,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.8×10-39)
(5)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(6)取28.7gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.Zn3O(SO4)2 C.ZnSO4 D.ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对称变换是一种建模方法。依据甲烷的一氯代物只有一种,采用如下代换;

下列说法错误的是
A.a、b、c互为同系物B.X的通式一定为CnH2n+2
C.b的同分异构体只有2种(不含立体异构)D.c的三氯代物只有7种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气和氨水在工农业生产中均有重要应用。
(1)工业合成氨反应的化学方程式是_________。
(2)实验室常加热熟石灰[主要成分是Ca(OH)2]和氯化铵混合固体制取氨气,写出反应的化学方程式___________。
(3)如图所示,向表面皿中的NaOH固体滴几滴浓氨水,迅速盖上盖,观察现象。
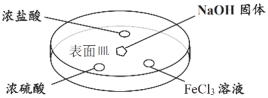
①___________液滴上方会出现白烟(填序号)
A.浓盐酸 B.浓硫酸 C.FeCl3溶液
②一段时间后浓硫酸的液滴中有白色固体,生成该白色固体的化学方程式是_______。
③FeCl3液滴中出现的现象是___________,发生反应的离子方程式是_________。
(4)利用氨水可以将大气污染物SO2吸收并生产氮肥,原理如图所示:
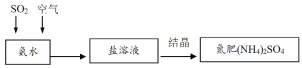
分析上述生产原理,在下列表格中填写该生产过程中利用的SO2的化学性质并进行理论论证
SO2的化学性质 | 理论论证 |
______ | ______ |
______ | ______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是一种难溶于水的白色粉末,不溶于乙醇,可溶于浓盐酸和氨水,在潮湿空气中被氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。工业上常以海绵铜(主要成分是 Cu,含有少量CuO)为原料生产CuCl,其工艺流程如下:
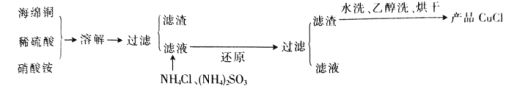
(1)配平“溶解”过程中发生的氧化还原反应的离子方程式:
____Cu+___+____![]() = _____Cu2++____ NO↑ +___H2O
= _____Cu2++____ NO↑ +___H2O
(2)还原“”过程中,作还原剂的是_________(填化学式);写出“还原”过程中发生反应的离子方程式:_________。
(3)写出氯化亚铜在潮湿的空气中被氧化的化学方程式: ______。
(4)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,并在真空干燥机内于70℃下干燥2 h,冷却密封包装。密封包装的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
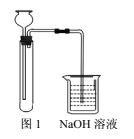
【题目】某化学实验小组拟探究改进Fe(OH)2的制取方法。
方案1:
①实验药品:FeS固体、稀硫酸溶液、NaHCO3溶液;
②实验装置如图1。
方案2:
①取一只试管,向其中加入一粒NaOH固体,再加入约2mL新制的FeSO4溶液;
②将试管置于酒精灯火焰上,对着有NaOH颗粒的部位小心加热(不能使液体剧烈沸腾)。使沉淀自下至上慢慢增多,观察下部沉淀颜色。
方案3:
①先在试管中滴入2~3 mL液体石蜡;
②用胶头滴管小心往试管底部注入4~5 mL新制的FeSO4溶液;
③再往试管中投入1粒绿豆大小的金属钠,观察反应现象。
回答下列问题:
(1)“方案1”中,后加入试管中的液体是______,NaOH溶液的作用是_______。
(2)“方案2”中,对着有NaOH颗粒的部位小心加热的目的是________。
(3)“方案2”的沉淀中,上层沉淀的颜色是________,下层沉淀的颜色是________,发生此现象的原因是________。
(4)“方案3”中反应的化学反应方程式为________。
(5)“方案3”的实验过程中间断性的出现白色沉淀,其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。
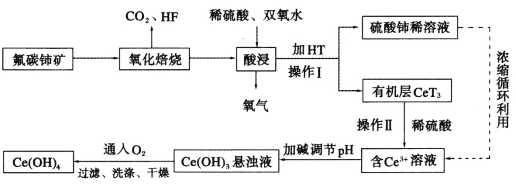
回答下列问题:
(1)CeFCO3中Ce的化合价为___________________。
(2)氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为_______。为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小。其原因是___。
(3)HT是一种难溶于水的有机溶剂,它能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层)![]() CeT3(有机层)+3H+(水层)。操作I的名称是_________操作Ⅱ加入稀H2SO4的目的是______。
CeT3(有机层)+3H+(水层)。操作I的名称是_________操作Ⅱ加入稀H2SO4的目的是______。
(4)向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在密闭容器中进行的可逆反应![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.容器内只含有![]() 、
、![]() 、
、![]() 三种分子
三种分子
B.![]() 只存在
只存在![]() 分子中
分子中
C.容器内含有![]() 、
、![]() 、
、![]() 等分子
等分子
D.反应达到限度时,所有物质的质量都相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com