
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应Fe2O3(s)+ CO(g) Fe(s)+ CO2(g) ΔH=-23.5kJ·mol-1,该反应在1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,应经过l0min后达到平衡。
Fe(s)+ CO2(g) ΔH=-23.5kJ·mol-1,该反应在1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,应经过l0min后达到平衡。
(1)CO的平衡转化率=____________
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________。
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+ 2H2(g) 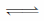 CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
(3)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________。
(4)已知氢气的燃烧热286kJ/mol,请写出甲醇气体不充分燃烧的热化学方程式____________________________________________________________________。
(5)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是________
A.c1=c2
B.2Q1=Q3
C.2α1=α3
D.α1+α2 =1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
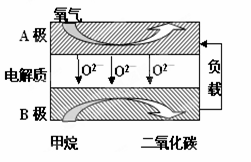
(6) B极上的电极反应式为 。
(7)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标况下)。
【答案】I.(1)60%
(2)d
Ⅱ.(3)0.15mol/(L·min)
(4)CH3OH(g)+O2(g) 2H2O(l)+CO(g) △H=-481kJ/mol
2H2O(l)+CO(g) △H=-481kJ/mol
(5) ADE
Ⅲ.(6) CH4 + 4O2--8e- CO2+ 2H2O;
CO2+ 2H2O;
(7) 1.12 L
【解析】本题考查了化学平衡移动原理、电解池、原电池原理及计算、盖斯定律等知识。
I.(1)设平衡时CO的物质的量变化为nmol,则:
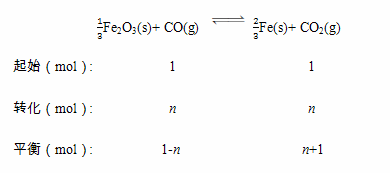
则K=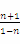 =4,解得n=0.6,则CO的平衡转化率为
=4,解得n=0.6,则CO的平衡转化率为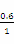 ×100%=60%。 (2)该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故a错。反应前后气体的物质的量不变,减小容器的容积,增大压强,平衡不移动,CO的平衡转化率不变,故b错。加入合适的催化剂,平衡不移动,故c错。移出部分CO2,平衡向正反应方向移动,CO的平衡转化率增大,故d正确。粉碎矿石,使其与平衡混合气体充分接触,平衡不移动,故e错。
×100%=60%。 (2)该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故a错。反应前后气体的物质的量不变,减小容器的容积,增大压强,平衡不移动,CO的平衡转化率不变,故b错。加入合适的催化剂,平衡不移动,故c错。移出部分CO2,平衡向正反应方向移动,CO的平衡转化率增大,故d正确。粉碎矿石,使其与平衡混合气体充分接触,平衡不移动,故e错。
Ⅱ.(3)达到平衡时生成甲醇为:0.75mol/L,则消耗的c(H2)=2×0.75mol/L=1.5mol/L,v(H2)=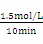 =0.15mol/(L min)。(4)由图二可得CO(g)+ 2H2(g)
=0.15mol/(L min)。(4)由图二可得CO(g)+ 2H2(g)  CH3OH(g) △H=-91 kJ/mol①,氢气燃烧的热化学方程式为2H2(g)+O2(g)
CH3OH(g) △H=-91 kJ/mol①,氢气燃烧的热化学方程式为2H2(g)+O2(g) 2H2O(l) △H=-572kJ/mol②,根据盖斯定律②-①可得甲醇气体不充分燃烧的热化学方程式为CH3OH(g)+O2(g)
2H2O(l) △H=-572kJ/mol②,根据盖斯定律②-①可得甲醇气体不充分燃烧的热化学方程式为CH3OH(g)+O2(g)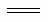 2H2O(l)+CO(g) △H=-481kJ/mol。(5)甲、乙相比较,把乙等效为开始加入1mol CO和2mol H2,和甲是等效的,甲乙是等效平衡,所以平衡时甲醇的浓度c1=c2,故A正确。甲、丙相比较,丙中反应物的物质的量为甲的2倍,压强增大,对于反应CO(g)+2H2(g)
2H2O(l)+CO(g) △H=-481kJ/mol。(5)甲、乙相比较,把乙等效为开始加入1mol CO和2mol H2,和甲是等效的,甲乙是等效平衡,所以平衡时甲醇的浓度c1=c2,故A正确。甲、丙相比较,丙中反应物的物质的量为甲的2倍,压强增大,对于反应CO(g)+2H2(g)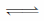 CH3OH(g),平衡向生成甲醇的方向移动,故2Q1<Q3,故B错。甲、丙相比较,丙中反应物的物质的量为甲的2倍,压强增大,对于反应CO(g)+2H2(g)
CH3OH(g),平衡向生成甲醇的方向移动,故2Q1<Q3,故B错。甲、丙相比较,丙中反应物的物质的量为甲的2倍,压强增大,对于反应CO(g)+2H2(g)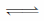 CH3OH(g),平衡向生成甲醇的方向移动,故a1<a3 ,故C错。甲、乙处于相同的平衡状态,而且反应方向相反,则α1+α2=1 ,故D正确。甲、乙处于相同的平衡状态,而且反应方向相反,两个方向转化的和恰好为1mol,所以该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量,故E正确。Ⅲ.(6)通入燃料甲烷的电极是负极,通入氧气的电极是正极。负极发生的电极式为CH4 + 4O2--8e-
CH3OH(g),平衡向生成甲醇的方向移动,故a1<a3 ,故C错。甲、乙处于相同的平衡状态,而且反应方向相反,则α1+α2=1 ,故D正确。甲、乙处于相同的平衡状态,而且反应方向相反,两个方向转化的和恰好为1mol,所以该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量,故E正确。Ⅲ.(6)通入燃料甲烷的电极是负极,通入氧气的电极是正极。负极发生的电极式为CH4 + 4O2--8e-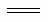 CO2+ 2H2O。
CO2+ 2H2O。
(7)电解硫酸铜溶液时阳极的电极反应式为4OH--4e-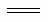 O2↑+ 2H2O,阴极的反应式为Cu2++2e-
O2↑+ 2H2O,阴极的反应式为Cu2++2e-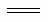 Cu;2H++2e-
Cu;2H++2e-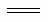 H2↑。n(Cu)=0.1mol,若两极收集到的气体体积相等,设其物质的量为n。
H2↑。n(Cu)=0.1mol,若两极收集到的气体体积相等,设其物质的量为n。
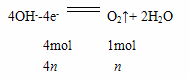

根据两极转移的电子数相同,则4n=0.1×2+2n。解得n=0.1,共转移的电子的物质的量为0.4mol,由于在整个反应过程转移电子相等,故甲烷放电时转移的电子的物质的量也为0.4mol。
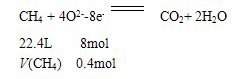
V(CH4)=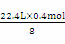 =1.12L
=1.12L


科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | PH小于7时一定为酸性 |
|
| B. | 水离子积Kw与 温度、酸碱性有关 |
|
| C. | c(H+)=c(OH﹣)的溶液一定为中性溶液 |
|
| D. | 加入酸或碱促进水电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知元素X的基态原子最外层电子排布为nsn﹣1npn+2,则它最高价氧化物对应的水化物的酸根离子是( )
|
| A. | RO | B. | RO43﹣ | C. | RO | D. | RO32﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)⇌CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)= mol•L﹣1•min﹣1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)= mol.
(3)保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率 (填“增大”或“减小”或“不变”),H2O的体积分数 (填“增大”或“减小”或“不变”).
(4)温度升至800℃,上述反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热”).
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NaHSO4在水中的电离方程式为NaHSO4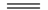 Na+ + H++
Na+ + H++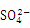 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。对于该溶液,下列叙述中不正确的是
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。对于该溶液,下列叙述中不正确的是
A.该温度高于25℃
B.水电离出来的c(H+)= 1×10-10 mol • L﹣1
C.c(H+)=c(OH-))+c(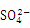 )
)
D.该温度下加入等体积pH为12的NaOH溶液可使反应后的溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
已知同周期两种非金属元素X、Y,电负性X>Y,下列说法错误的是
| A.含氧酸的酸性:X对应的强于Y对应的 | B.气态氢化物的稳定性:HmX强于HnY |
| C.第一电离能可能Y大于X | D.X与Y形成化合物时,X显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某条件下,在2 L密闭容器中发生如下反应:2NO2(g)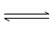 2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800 ℃,实验Ⅲ在850 ℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800 ℃,实验Ⅲ在850 ℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:

(1)实验Ⅱ隐含的反应条件是 。
(2)实验II中,从反应开始至达到平衡,用氧气浓度变化表示的化学反应速率为 。
(3)800 ℃时,该反应的平衡常数K= 。该反应是 (填“吸” 或“ 放”)热反应。
(4)若实验Ⅰ中达到平衡后,再向密闭容器中通入2 mol由物质的量之比为1∶1组成的NO2与O2混合气体(保持温度不变),此时反应将向 (填“正反应”或“逆反应”)方向进行。
(5)NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,如:8NH3+6NO2 7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
(6)向AlCl3溶液中逐滴加入氨水,发生如下反应Al3++3NH3·H2O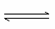 Al(OH)3↓+3
Al(OH)3↓+3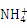 ,一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已完全。已知当溶液中Al3+恰好沉淀完全时溶液的pH=4.7,则Al(OH)3的溶度积常数为 (已知:lg2=0.3)。
,一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已完全。已知当溶液中Al3+恰好沉淀完全时溶液的pH=4.7,则Al(OH)3的溶度积常数为 (已知:lg2=0.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
由水电离产生的c(H+)和c(OH﹣)的乘积为1×10﹣18的溶液里,可能大量共存的离子组( )
|
| A. | NH4+、Na+、Cl﹣、I﹣ | B. | Na+、K+、Fe3+、SCN﹣ |
|
| C. | Na+、Al3+、Cl﹣、AlO2﹣ | D. | Na+、K+、Cl﹣、HCO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
以溴乙烷为原料,用下述六种反应的类型:
(1)氧化(2)消去(3)加成(4)酯化(5)水解(6)加聚,
来合成乙二酸乙二酯的正确顺序( )
|
| A. | (1)(5)(2)(3)(4) | B. | (1)(2)(3)(4)(5) | C. | (2)(3)(5)(1)(4) | D. | (2)(3)(5)(1)(6) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com