
| A. |  分离甘油和水 分离甘油和水 | B. | 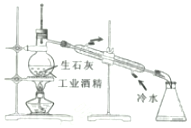 用工业酒精制取无水酒精 用工业酒精制取无水酒精 | ||
| C. | 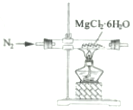 制取MgCl2固体 制取MgCl2固体 | D. | 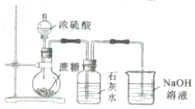 检测蔗糖与浓硫酸反应产生的CO2 检测蔗糖与浓硫酸反应产生的CO2 |
分析 A.甘油和水混溶;
B.酒精易挥发,可用蒸馏的方法制备;
C.加热时氯化镁易水解;
D.浓硫酸和蔗糖反应生成二氧化硫和二氧化碳,都使石灰水变浑浊.
解答 解:A.甘油和水混溶,不能用分液的方法分离,故A错误;
B.酒精易挥发,可用蒸馏的方法制备,温度计以及水的进出方向正确,故B正确;
C.加热时氯化镁易水解,应通入氯化氢,抑制水解,故C错误;
D.浓硫酸和蔗糖反应生成二氧化硫和二氧化碳,都使石灰水变浑浊,应先除去二氧化硫,故D错误.
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质的分离、检验等知识点,把握实验操作的规范性、实验细节和实验原理为解答的关键,注意方案的合理性、评价性、操作性分析,易错选项是D.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
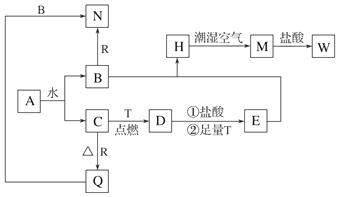
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
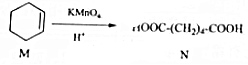 ,下列有关说法中正确的是( )
,下列有关说法中正确的是( )| A. | M中所有碳原子均位于同一平面,且与苯互为同系物 | |
| B. | 与N含有相同官能团的同分异构体共有8种 | |
| C. | M能发生加成反应和取代反应 | |
| D. | N与乙醇发生酯化反应,生成物的分子式一定为C8H14O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,X的电子式是
,X的电子式是 ,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com