
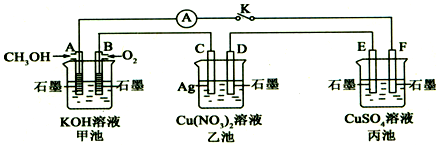
分析 (1)根据燃料电池的工作原理和原电池的形成条件回答;
(2)甲池中,通入甲醇的电极是负极,通入氧气的电极是正极,所以F是阴极,E是阳极,D是阴极,C是阳极,电解硫酸铜溶液的电极反应式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2H2SO4+2Cu+O2↑;
(3)根据电子守恒来计算回答;
(4)根据溶液复原的方法:出什么加什么来回答.
解答 解:(1)乙池Ag和硝酸铜溶液不反应,丙池无活性电极,甲池是燃料电池,属于原电池,在该燃料电池中,负极上是甲醇发生失电子的氧化反应,在碱性环境下,CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:原电池; CH3OH-6e-+8OH-=CO32-+6H2O;
(2)甲池中,通入甲醇的电极是负极,通入氧气的电极是正极,所以F是阴极,E是阳极,D是阴极,C是阳极,电解硫酸铜溶液的电极反应式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2H2SO4+2Cu+O2↑,故答案为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2H2SO4+2Cu+O2↑;
(3)C极上的电极反应为:Ag-e-=Ag+,B电极上的电极反应为:O2+2H2O+4e-=4OH-,当池中C极质量减轻10.8g时,即转移电子是0.1mol,此时甲池中B电极理论上消耗O2的物质的量是0.25mol,体积为0.25mol×22.4L/mol=0.56L=560mL,故答案为:560;
(4)丙池用惰性电极电解硫酸铜溶液,在阴极上是铜离子得电子生成金属铜的反应,阳极上氢氧根离子失电子生成氧气,溶液中减少了Cu和O元素的质量,所以要让电解质复原,需要加入CuO或CuCO3,故答案为:CuO或CuCO3.
点评 本题考查了原电池电解池的相互串联问题,注意首先区分原电池和电解池,题目难度中等.


科目:高中化学 来源: 题型:解答题
 (1)甲醇(CH3OH)是一种重要的化工原料.已知 CH3OH(1)+O2(g)=CO(g)+2H2O(g);△H=-443.64kJ•mol-1
(1)甲醇(CH3OH)是一种重要的化工原料.已知 CH3OH(1)+O2(g)=CO(g)+2H2O(g);△H=-443.64kJ•mol-1 2B+C.
2B+C.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
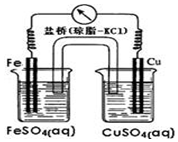
| A. | 铜作正极,发生氧化反应 | |
| B. | 外电路中电流方向为Fe→Cu | |
| C. | Fe电极的电极反应式为Fe-3e-=Fe3+ | |
| D. | 盐桥将两电解质溶液连接起来,传导电流,通过等量的K+和Cl-的定向移动,使两电解质溶液保持电中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂,v正、v逆都发生变化,且变化的倍数相等 | |
| B. | 加压、v正、v逆都增大,且v正大于v逆 | |
| C. | 降温,v正、v逆减小,且v正小于v逆 | |
| D. | 体积不变,加入氮气,v正、v逆都增大,且v正大于v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
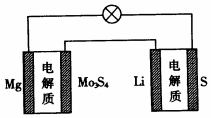 已知:镁电池的总反应为xMg+Mo3S4$?_{放电}^{充电}$MgxMo3S4,锂硫电池的总反应为2Li+S$?_{放电}^{充电}$Li2S.下列说法正确的是( )
已知:镁电池的总反应为xMg+Mo3S4$?_{放电}^{充电}$MgxMo3S4,锂硫电池的总反应为2Li+S$?_{放电}^{充电}$Li2S.下列说法正确的是( )| A. | 镁电池放电时,Mg2+向负极迁移 | |
| B. | 镁电池放电时,正极发生的电极反应为Mo3S4+2xe-=Mo3S42- | |
| C. | 理论上两种电池的比能量相同(参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量) | |
| D. | 图中Li作负极,Mo3S4作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| C. | 浓硫酸具有脱水性,可用于干燥氢气 | |
| D. | MgO、Al2O3熔点高,可用于制作耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS | |
| B. | 已知CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2 | |
| C. | 已知Na与水反应生成NaOH,推测Fe与水蒸汽反应生成Fe(OH)3 | |
| D. | 已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com