
| A. | Q1>Q3>Q2 | B. | Q1>Q2>Q3 | C. | Q2>Q1>Q3 | D. | Q3>Q1>Q2 |
分析 先根据温度变化所引起平衡移动的方向判断反应①、反应②的热效应,然后利用盖斯定律判断即可.
解答 解:当温度降低时,反应①的平衡向正反应方向移动,说明该反应正向为放热反应,△H<0,反应②的平衡向逆反应方向移动,说明该反应正向为吸热反应,△H>0,
已知下列两个气态物质之间的反应:C2H2(g)+H2(g)?C2H4(g)…①,
2CH4(g)?C2H4(g)+2H2(g)…②,
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
(1)C(s)+2H2(g)?CH4(g),△H=-Q1…Ⅰ
(2)C(s)+$\frac{1}{2}$H2(g)?$\frac{1}{2}$C2H2(g),△H=-Q2…Ⅱ
(3)C(s)+H2(g)?$\frac{1}{2}$C2H4(g),△H=-Q3…Ⅲ,
利用盖斯定律,2×[(3)-(2)],得到C2H2(g)+H2(g)?C2H4(g),△H=2(Q2-Q3),
与题干中的①中的方程式一样,而①中的反应为放热反应,则Q2-Q3<0,所以Q2<Q3;
同理:2×[(3)-(1)],得到2CH4(g)?C2H4(g)+2H2(g),△H=2(Q1-Q3),与题干中的②中的方程式一样,而②中的反应为吸热反应,则2(Q1-Q3)>0,所以Q1>Q3;
综上所述Q1>Q3>Q2.
故选:A.
点评 本题考查了反应热的计算、热化学方程式和盖斯定律计算应用,为高频考点,侧重考查学生的分析、计算能力的考查,注意把握反应热的计算方法、热化学方程式的书写方法以及盖斯定律的含义,题目难度中等


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
| v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
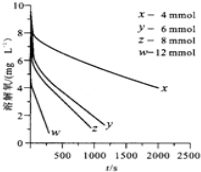
| 反应阶段 | 速率方程 | $\frac{k(297.0K)}{k(291.5K)}$ |
| 富氧区 | v=kc(SO32-)•c(O2) | 1.47 |
| 贫氧区 | v=kca(SO32-)•cb(O2) | 2.59 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
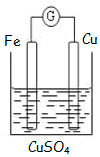 如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
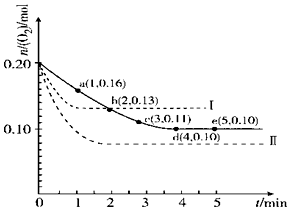 一定温度下,在2L的密闭容器中充入0.4mol SO2和0.2mol O2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,n(O2)随时间的变化关系如图实线所示:
一定温度下,在2L的密闭容器中充入0.4mol SO2和0.2mol O2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,n(O2)随时间的变化关系如图实线所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 三种酸的电离常数关系:KHA>KHB>KHD | |
| B. | 滴定至P点时,溶液中:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | 操作1 | 操作2 | 操作3 | 操作4 |
| A | 溶解 | 结晶 | 蒸发 | 过滤 |
| B | 蒸发 | 过滤 | 冷却 | 过滤 |
| C | 蒸发 | 结晶 | 结晶 | 蒸发 |
| D | 过滤 | 结晶 | 冷却 | 结晶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
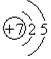
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com