
相同体积的氯化钠、氯化镁、氯化铝溶液分别与过量的硝酸银溶液反应,所生成的沉淀物质的量相同,则原氯化钠、氯化镁、氯化铝溶液的物质的量浓度之比为
| A.6 :3 :2 | B.3 :2 :1 | C.6 :3 :1 | D.1 :2 :3 |
科目:高中化学 来源: 题型:单选题
NA表示阿伏加德罗常数,以下各物质所含分子数最多的是( )
| A.标准状况下11.2 L氯气 | B.17g氨气 |
| C.0.8mol氧气 | D.4℃时,36mL的H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
Ⅰ、甲同学欲配制0.55 mo1·L—1 的NaOH溶液200mL(存在200mL容量瓶)。称量操作如下:
①先用托盘天平称量烧杯的质量。称量前先调节天平零点。用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码。取用砝码情况和游码读数如下:
| 砝码质量 | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 | 先↓后↑ | ↓ | 先↓后↑ | ↓ | 先↓后↑ |
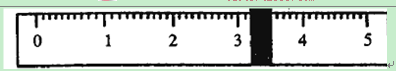
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.3.01×1023个SO2分子的质量为32g |
| B.CH4的摩尔质量为16g |
| C.1 mol H2O的质量为18g/mol |
| D.标准状况下,1 mol任何物质体积均为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.常温下,23 g NO2含有NA个氧原子 |
| B.1molFe与过量的稀HNO3反应,转移2 NA个电子 |
| C.1mol/L NaCl溶液含有NA个Na+ |
| D.常温常压下,22.4 L的NO2和CO2混合气体含有2 NA个O原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,2.24 L CHCl3的原子总数为0.1 NA |
| B.4.2 g C3H6中含有的碳碳双键数一定为0.1 NA |
| C.1 mol —OH中电子数为10 NA |
| D.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图,抽走玻璃片使氨气与氯化氢充分反应。下列有关描述合理的是(NA表示阿伏加德罗常数)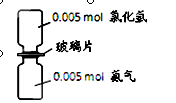
| A.反应前气体反应物的总体积为0.224 L |
| B.生成物的分子个数为0.005 NA |
| C.产物中的N-H键个数为0.02NA |
| D.加水溶解后所得溶液中NH4+数目为0.005 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com