
| A. | 1mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | pH=2的醋酸用水稀释至原体积10倍后,溶液中H+的数目大于0.001NA | |
| C. | 常温常压下,92g NO2和N2O4的混合气体含有的氧原子数为4NA | |
| D. | 500mL0.2mol•L-1的MgSO4溶液中,SO42-所带负电荷数为0.1NA |
分析 A.亚铁离子和碘离子均能与氯气反应;
B.溶液体积未知;
C.NO2和N2O4混合气体最简式相同为NO2,计算92gNO2中含有的氧原子数;
D.依据n=CV计算硫酸镁物质的量,结合1mol硫酸镁含有1mol硫酸根离子,1个硫酸根子带2个负电解答.
解答 解:A.亚铁离子和碘离子均能与氯气反应,故1molFeI2与足量氯气反应时能转移3mol电子即3NA个,故A错误;
B.溶液体积未知,无法计算氢离子个数,故C错误;
C.NO2和N2O4混合气体最简式相同为NO2,计算92gNO2中含有的氧原子数=$\frac{92g}{46g/mol}$×2×NA=4NA,故C正确;
D.500mL0.2mol•L-1的MgSO4溶液中含有硫酸镁物质的量为0.2mol/L×0.5L=0.1mol,含有硫酸根离子物质的量为0.1mol,SO42-所带负电荷数为0.2NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的分析应用,掌握物质的量的计算公式和物质结构是解题关键,题目难度不大.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
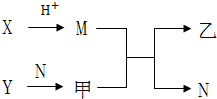 已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中不正确的是( )
已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中不正确的是( )| A. | A、C、D的常见氧化物相互之间一定能反应 | |
| B. | 相对分子质量M>N,沸点N>M | |
| C. | 简单离子半径:C2->B2->D+>A+ | |
| D. | D与其他元素均能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与少量NaHCO3溶液反应 | |
| B. | 澄清石灰水与过量NaHCO3溶液反应 | |
| C. | Ca(HCO3)2溶液与过量NaOH溶液反应 | |
| D. | 澄清石灰水与过量Ca(HCO3)2溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体的制备:Fe3++3NH3•H2O═Fe(OH)3(胶体)+3NH4+ | |
| B. | 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 铅酸蓄电池充电时的阳极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- | |
| D. | 用过量氨水吸收工业尾气中的SO2:NH3•H2O+SO2═NH4++HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡吸热反应均需在加热条件下才能发生 | |
| B. | 离子化合物中不可能含有共价键 | |
| C. | 液氨作为清洁能源的反应原理是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O | |
| D. | 实验收集NO和乙烯常用排水法不能用排空气法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③①④②⑥⑤ | B. | ①③⑥④②⑤ | C. | ③②①⑥④⑤ | D. | ⑤⑥②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯的一氯代物 | B. | 分子式为C5H10的烯烃 | ||
| C. | 相对分子质量为74的一元醇 | D. | 立方烷( )的二硝基取代物 )的二硝基取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com