
 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:分析 (1)铝是活泼性较强的金属,能迅速和空气中的氧气反应生成氧化铝,根据氧化铝的性质分析;
(2)金属和酸的反应是放热反应,温度升高是影响反应速率的主要因素,根据温度对化学反应速率的影响分析,溶液的浓度是影响化学反应速率的主要因素;
(3)据化学方程式可知,硫酸与氢气化学计量数相同,v(H2SO4)=v(H2),据此分析;
(4)减缓反应速率,可降低浓度、温度,不影响生成氢气的总量,则氢离子的物质的量不变,以此解答;
(5)催化剂加快反应速率,不影响氢气的产量.
解答 解:(1)铝是活泼性较强的金属,能迅速和空气中的氧气反应生成氧化铝,氧化铝首先稀硫酸反应生成氯化铝和水,不产生H2,化学方程式为2Al+3H2SO4=Al2(SO4)3+3H2↑故答案为:2Al+3H2SO4=Al2(SO4)3+3H2↑;
(2)金属和酸的反应是放热反应,使溶液的温度升高,温度升高是影响反应速率的主要因素,化学反应速率加快,随着反应的进行,溶液中的氢离子浓度逐渐降低,氢离子浓度是影响化学反应速率的主要因素,所以反应速率逐渐减小,
故答案为:该反应放热,c点前温度对反应速率的影响大于浓度对反应速率的影响,c点后浓度对反应速率的影响较大;
(3)据化学方程式可知,硫酸与氢气化学计量数相同,v(H2SO4)=v(H2)=$\frac{V}{11.2(b-c)}$,故答案为:$\frac{V}{11.2(b-c)}$;
(4)减缓反应速率,可降低浓度、温度,不影响生成氢气的总量,则氢离子的物质的量不变,①加NaOH固体能够反应氢离子,氢离子物质的量减少;②加适量BaCl2溶液相当于加水稀释;③加KNO3溶液,生成硝酸,不生成氢气;④加适量H2O,氢离子浓度减小;⑤将镁条换成镁粉,加快反应速率;⑥加小苏打溶液,能够反应氢离子,氢离子物质的量减少;⑦加少量CuSO4溶液,形成原电池,反应速率加快;则符合要求的有②③④⑧,
故答案为:②③④⑧;
(5)催化剂加快反应速率,不影响氢气的产量,
故答案为:不会.
点评 本题考查了化学反应速率的影响因素以及反应速率的计算,难度不大,注意根据图象分析理解随反应进行影响反应速率的主导元素.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | “四中子”不显电性 | |
| B. | “四中子”的质量数为4,其质量比氢原子大 | |
| C. | “零号元素”在元素周期表中与氢元素占同一位置 | |
| D. | 第二种粒子的化学式为O4,与O2互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 运动员服用兴奋剂是违背人文道德的.某种兴奋剂的结构简式如下图所示,有关该物质的说法错误的是( )
运动员服用兴奋剂是违背人文道德的.某种兴奋剂的结构简式如下图所示,有关该物质的说法错误的是( )| A. | 滴入KMnO4(H+)溶液,观察到紫色褪去 | |
| B. | 该分子中的所有碳原子可能共平面 | |
| C. | 1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol | |
| D. | 遇FeCl3溶液不显颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素和非金属元素间形成的化学键一定是离子键 | |
| B. | 伴有能量变化的物质变化不一定是化学变化 | |
| C. | 可逆反应达到化学平衡时,正逆反应速率都为0 | |
| D. | 通过化学变化可以实现1H与2H间的相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式是C3H8O3 | |
| B. | A催化氧化的产物能发生银镜反应 | |
| C. | 0.1 mol A与足量Na反应产生2.24 L H2(标准状况) | |
| D. | A在一定条件下发生缩聚反应的产物是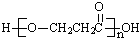 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com