
【题目】25℃时,部分含Fe元素的徽粒在溶液中的物质的量分数与溶液pH的关系如图所示,下列说法正确的是

A. HFeO4-在水中的电离程度小于水解程度
B. B、C两点对应溶液中水的电离程度:B > C
C. B点溶液加适里水稀释,溶液中所有离子浓度均减小
D. 由A点数据可知,H2FeO4的第一步电离平衡常数Ka1=4.15×l0-4
【答案】D
【解析】A. HFeO4-在水中既能电离又能水解,其电离使溶液显酸性,其水解使溶液显碱性,由图像可知,物质的量分数最大时pH约为5,所以电离程度大于水解程度,A不正确;B. B点pH约为3,溶液显酸性,溶液的酸性是由高铁酸和高铁酸氢根的电离决定的,而C点的pH约为7,是由高铁酸氢根的电离和高铁酸根的水解共同决定的,酸的电离对水的电离有抑制作用,酸性越强,抑制作用越大,而酸根水解会促进水的电离 ,溶液的pH越大,则对水的电离的促进作用就越大,所以B、C两点对应溶液中水的电离程度:B < C,所以B不正确;C. B点溶液加适里水稀释,溶液中所有离子浓度均减小肯定是不正确的,因为在一定温度下,水的离子积是定值,所以不可能均减小,C不正确;D. 由A点数据可知,A点对应的溶液中pH=4,HFeO4-的物质的量分数为80.6%,则H2FeO4的物质的量分数为19.4%,所以两者的物质的量之比为![]() = 4.15,c(H+)=10-4mol/L,H2FeO4的第一步电离平衡常数Ka1=
= 4.15,c(H+)=10-4mol/L,H2FeO4的第一步电离平衡常数Ka1= 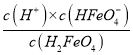 = 4.15×l0-4,D正确。
= 4.15×l0-4,D正确。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作和现象所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2(g) | 增大压强,平衡逆向移动 |
B | 向某溶液中滴加稀盐酸,再加KSCN溶液,溶液变为血红色 | 原溶液中一定含有Fe3+ |
C | 用滴定管量取20.00mL稀硫酸,初读数时尖嘴处有气泡,末读数时气泡消失 | 所取稀硫酸体积小于20.00mL |
D | 25℃时,分别测定等物质的量浓度的Na2C2O4溶液和NaF溶液的pH,前者pH大 | 酸性:H2C2O4<HF |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量的铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为
A.3︰2 B.1︰2 C.3︰1 D.6︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22,下列说法正确的是

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是
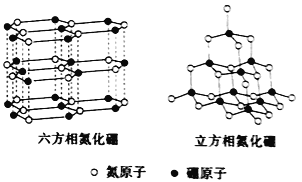
A. 立方相氮化硼含有σ键和π键,所以硬度大
B. 六方相氮化硼层间作用力小,所以质地软
C. 两种晶体中存在的作用力均为共价键
D. 两种晶体均为分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是
A. 晶体熔点的高低: >
>
B. 硬度由大到小:金刚石>碳化硅>晶体硅
C. 熔点由高到低:Na>Mg>Al
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com