
【题目】I、为测定金属钠样品(表面有 Na2O)的钠单质的质量分数,设计了如下实验(反应装置如右图所示):
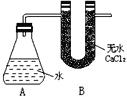
①称量 A、B的总质量 ②称取一定质量的钠样品 ③将钠样品投入锥形瓶中,迅速塞紧带U形干燥管的橡皮塞
有关数据是:称取的金属钠样品质量为a g, A、B反应前总质量为b g,反应后A、B的总质量为c g。
请根据题意回答下列问题:
(1)钠与水反应的离子方程式为________________________________。
(2)用 a、b、c表示的钠单质的质量分数为________________________________。
(3)没有B装置对实验结果有何影响________(填“偏大”或“偏小”“不影响”)?
Ⅱ、现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下图。回答下列问题(注:Na2O2可以与H2O、CO2反应):
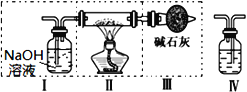
(1)上述装置Ⅳ中盛放的试剂是___________,为完成实验应将装置Ⅳ接在______(选填)。
A.Ⅰ之前 B. Ⅰ和Ⅱ之间 C. Ⅱ和Ⅲ之间 D. Ⅲ之后
(2)装置Ⅲ的作用 ________________________________________________________。
(3)为制得更纯的Na2O2,应______(填“先”或“后”,下同)通空气______点燃酒精灯。
(4)点燃酒精灯后,观察到装置 II 中的现象为 _______________________________。
【答案】 2Na+2H2O =2Na++2OH-+H2↑ 23(a+b-c)/a 偏大 浓硫酸 B 防止空气中的水蒸气和二氧化碳进入Ⅱ中 先 后 钠熔化成光亮的小球,剧烈燃烧产生黄色火焰,生成淡黄色固体
【解析】I、(1)钠与水反应生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑。(2)A、B反应前减少的质量就是反应中生成的氢气质量,为(a+b-c)g,氢气的物质的量是![]() ,根据方程式可知金属钠的质量是
,根据方程式可知金属钠的质量是![]() ,所以用a、b、c表示的钠单质的质量分数为
,所以用a、b、c表示的钠单质的质量分数为![]() ;(3)没有B装置,氢气会带出水蒸气,导致氢气的质量增加,所以结果会偏大;
;(3)没有B装置,氢气会带出水蒸气,导致氢气的质量增加,所以结果会偏大;
Ⅱ、(1)由于过氧化钠能与水及二氧化碳反应,且钠能与水反应,因此利用氢氧化钠溶液除去空气中的二氧化碳,利用浓硫酸干燥空气,所以上述装置Ⅳ中盛放的试剂是浓硫酸,为完成实验应将装置Ⅳ接在Ⅰ和Ⅱ之间,答案选B;(2)由于空气中含有水蒸气和二氧化碳,则装置Ⅲ中碱石灰的作用是防止空气中的水蒸气和二氧化碳进入Ⅱ中。(3)根据以上分析可知为制得更纯的Na2O2,应先通空气后点燃酒精灯。(4)点燃酒精灯后,观察到装置II中的现象为钠熔化成光亮的小球,剧烈燃烧产生黄色火焰,生成淡黄色固体。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】已知下图所示物质相互转化关系,其中A 为单质,试回答:
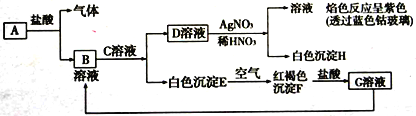
(1)写出下列物质的化学式:C____________;H_________________。
(2)写出A与水蒸气反应的化学方程式___________________________________。
(3)实验室保存B溶液时常加入少量固体A,其原因是___________________________________。
(4)写出E转变成F的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不是Fe(OH)3胶体和MgCl2溶液共同具备的性质是( )
A. 都比较稳定,密封放置不产生沉淀 B. 都有丁达尔效应
C. 加入少量NaOH溶液都可产生沉淀 D. 分散质微粒均可透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验,下列有关说法正确的是( )
![]()
A.步骤I中减少的3g固体一定是混合物
B.步骤II中质量减少的物质一定是Cu
C.根据步骤I、II可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
D.根据上述步骤II可以得出m(Fe2O3):m(Cu)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质的说法中正确的是( )
A.氨溶于水可导电,所以氨是电解质
B.氧化钠熔融时能导电,所以氧化钠是电解质
C.液态的铜导电性很好,所以铜是电解质
D.二氧化硫水溶液的导电性很好,所以二氧化硫是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,将0.200mol的四氧化二氮气体充入2L真空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如表格:
| 0 | 2 | 4 | 6 | 8 | 10 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应达到平衡时,四氧化二氮的转化率为%,表中c2c3、ab(填“>”、“<”或“=”).
(2)2min时四氧化二氮的浓度c1=mol/L,在0~2min时间段内,四氧化二氮的平均反应速率为mol/(Lmin).
(3)100℃时,该反应的平衡常数K=
(4)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】指出下列反应中的氧化剂和还原剂。
(1)Cl2 + SO2 + 2H2O = H2SO4 + 2HCl;氧化剂:___________,还原剂:___________;
(2)2KNO3+S+3C ![]() K2S+N2↑+3CO2↑;氧化剂:___________,还原剂:___________;
K2S+N2↑+3CO2↑;氧化剂:___________,还原剂:___________;
(3)4FeS2 + 11O2 ![]() 2Fe2O3 + 8SO2;氧化剂:___________,还原剂:___________。
2Fe2O3 + 8SO2;氧化剂:___________,还原剂:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含Cr2O72﹣的废水毒性较大,某工厂废水中含5.0×10﹣3 molL﹣1的Cr2O72﹣ . 为了使废水的排放达标,进行如下处理: ![]()
①绿矾化学式为FeSO47H2O.反应(I)的离子方程式为 .
②若处理后的废水中c(Cr3+)=3.0×10﹣6 molL﹣1 , 则废水中c(Fe3+)=molL﹣1 . (Ksp[Fe(OH)3]=4.0×10﹣38 , Ksp[Cr(OH)3]=6.0×10﹣31)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com