
分析 (1)同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;Cu原子核外有29个电子,Cu原子失去最外层一个电子生成亚铜离子,根据构造原理书写亚铜离子核外电子排布式;
(2)分子晶体 的熔沸点较低;该物质在空气中燃烧生成红棕色固体是氧化铁,同时还生成二氧化碳;
(3)该配合物中C原子价层电子对个数有3个、4个的,根据价层电子对互斥理论判断C原子杂化方式;用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有配位键和δ键生成;
(4)Cu、H2O2和NH3?H2O反应生成铜氨络合离子、氢氧根离子和水;
(5)利用均摊法计算晶胞中Fe原子个数;根据密度公式ρ=$\frac{\frac{M}{{N}_{A}}×Fe原子个数}{V}$.
解答 解:(1)同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以C、N、O元素第一电离能大小顺序是N>O>C;Cu原子核外有29个电子,Cu原子失去最外层一个电子生成亚铜离子,根据构造原理书写亚铜离子核外电子排布式为[Ar]3d10,
故答案为:N>O>C;[Ar]3d10;
(2)分子晶体 的熔沸点较低,该物质熔沸点较低,属于分子晶体;该物质在空气中燃烧生成红棕色固体是氧化铁,同时还生成二氧化碳,方程式为4Fe(CO)5+13O2 $\frac{\underline{\;点燃\;}}{\;}$ 2Fe2O3+20CO2,
故答案为:分子晶体;4Fe(CO)5+13O2 $\frac{\underline{\;点燃\;}}{\;}$ 2Fe2O3+20CO2;
(3)该配合物中C原子价层电子对个数有3个、4个的,根据价层电子对互斥理论确定C原子杂化方式为sp3、sp2;用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有Cu原子和N、C原子之间的配位键且也是δ键生成,
故答案为:sp2、sp3;bd;
(4)Cu、H2O2和NH3?H2O反应生成铜氨络合离子、氢氧根离子和水,反应方程式为Cu+H2O2+4NH3?H2O═[Cu(NH3)4]2++2OH?+4H2O(或Cu+H2O2+4NH3═[Cu(NH3)4]2++2OH?),
故答案为:Cu+H2O2+4NH3?H2O═[Cu(NH3)4]2++2OH?+4H2O(或Cu+H2O2+4NH3═[Cu(NH3)4]2++2OH?);
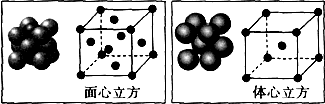
(5)利用均摊法计算晶胞中Fe原子个数,体心立方晶胞中Fe原子个数=1+8×$\frac{1}{8}$=2、面心立方晶胞中Fe原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、,所以二者Fe原子个数之比=2:4=1:2;
设Fe原子半径为rcm,体心立方晶胞半径=$\frac{4\sqrt{3}}{3}$rcm,体积=($\frac{4\sqrt{3}}{3}$rcm)3,
面心立方晶胞半径=2$\sqrt{2}$rcm,其体积=(2$\sqrt{2}$rcm)3,
其密度之比=$\frac{\frac{M}{{N}_{A}}×2}{(\frac{4\sqrt{3}}{3}r)^{3}}$:$\frac{\frac{M}{{N}_{A}}×4}{(2\sqrt{2}r)^{3}}$=3$\sqrt{3}$:4$\sqrt{2}$,
故答案为:1:2;3$\sqrt{3}$:4$\sqrt{2}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、离子方程式书写、配合物、原子杂化方式判断等知识点,侧重考查学生分析、计算及空间想象能力,明确物质结构、物质性质是解本题关键,难点是晶胞计算,注意晶胞中哪些原子紧密连接,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| 金属 | Na | Cu | Al | Fe |
| 熔点/℃ | 97.5 | 1083 | 660 | 1535 |
| 沸点/℃ | 883 | 2595 | 2200 | 3000 |
| A. | Cu与Al | B. | Fe与Cu | C. | Fe与Na | D. | Al与Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①③⑤ | C. | 仅有⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请完成下列各题
请完成下列各题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 112号元素是金属元素 | |
| B. | 112号元素位于第七周期,是主族元素 | |
| C. | ${\;}_{112}^{277}$R原子中子数为165 | |
| D. | 112号元素为放射性元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com