
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y===2Z,其平衡常数为1 600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
科目:高中化学 来源: 题型:
下列有关实验原理或操作正确的是
A. SO2气体的还原性较强,不能使其通过浓硫酸干燥
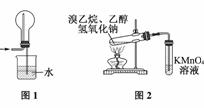 B. 滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定
B. 滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定
C. 用图1装置吸收多余的HCl气体
D. 用图2装置检验溴乙烷发生消去反应生成乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍.下列说法正确的是
A.微粒半径:Z2+>W2->R-
B.对应氢化物的稳定性:W>R
C.W与X、W与Z形成的化学物晶体类型相同
D.Y的最高价氧化物对应的水化物是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定的溶液中能大量共存的是( )
①无色溶液中:K+、Cu2+、Na+、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+
④在由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl-、S2-、ClO-
⑥强酸性溶液中:Fe2+、Al3+、NO3-、Cl-
A.①②⑤ B.②④⑥ C.②④ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)。一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO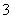 等离子其物质的量(mol)与反应时间t(min)的关系曲线。下列说法错误的是( )
等离子其物质的量(mol)与反应时间t(min)的关系曲线。下列说法错误的是( )

A.工业制取漂白液的化学反应方程式为Cl2+2NaOH===NaCl+NaClO+H2O
B.a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+)
C. t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-= 2Cl-+ClO3-
D.使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)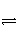
 Si(s)+4HCl(g)
Si(s)+4HCl(g)
ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中加入A、B、C三种气体,在温度为T K和(T+10)K时,测得各物质的浓度如下表。据此下列结论正确的是( )
| 温度 | T K | (T+10) K | |||
| 测定时刻/s | t1 | t2 | t3 | t4 | t5 |
| c(A)/mol·L-1 | 6 | 3 | 2 | 2 | 2.2 |
| c(B)/mol·L-1 | 5 | 3.5 | 3 | 3 | 3.1 |
| c(C)/mol·L-1 | 1 | 2.5 | 3 | 3 | 2.9 |
A.在t3时刻反应已经停止
B.升高温度,该反应的化学平衡常数将增大
C.在t3时刻,若增大压强,则A的转化率将减小
D.在t2~t3内A的平均反应速率为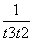 mol·L-1·s-1
mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列各项事实不能说明上述观点的是( )
A.甲苯能使酸性高锰酸钾溶液退色,而苯不能使酸性高锰酸钾溶液退色
B.乙烯能发生加成反应,而乙烷不能发生加成反应
C.苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生反应
D.乙烷在光照条件下能发生取代反应,而乙炔不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是
( )。
A.正极附近SO 浓度逐渐增大
浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.负极反应式为Zn-2e-===Zn2+
D.该原电池工作过程中电解质溶液的pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com