
|


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、②③④ | B、①②④ |
| C、①②③④ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
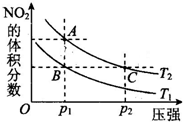 请回答下列问题
请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
| A、T1>T2,且a>0 |
| B、当温度为T2、反应进行到40 min时,x>0.15 |
| C、温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol |
| D、温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50 molH2O(g),反应开始时,ν(正)>ν(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 四种常见元素的性质或结构信息如下表.试根据信息回答有关问题.
四种常见元素的性质或结构信息如下表.试根据信息回答有关问题.| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol Cl2与足量NaOH溶液反应,转移电子的数目为0.2NA |
| B、0.1mol苯乙烯中含有碳碳双键的数目为0.4NA |
| C、标准状况下,11.2L乙醇中含有羟基的数目为0.5NA |
| D、4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com