
下列叙述中正确的是
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HCl、HBr、HI的稳定性依次增强
D.CS2、H2O、C2H2都是直线型分子
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
[化学—物质结构与性质]石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示]。
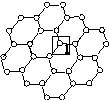
(a)石墨烯结构 (b)氧化石墨烯结构
(1)图(a)中,1号C与相邻C形成σ键的个数为________。
(2)图(b)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。
(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
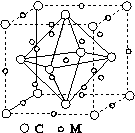
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推论正确的
A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B.NH4+为正四面体结构,可推测出PH4+ 也为正四面体结构
C.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D.C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
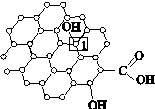
(1)中国古代四大发明之一——黑火药,它的爆炸反应为
 (已配平)
(已配平)
①除S外,上列元素的电负性从大到小依次为 。
②在生成物中,A的晶体类型为 ,含极性共价键的分子的中心原子轨道杂化类型为 。
③已知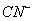 与
与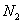 结构相似,推算HCN分子中
结构相似,推算HCN分子中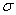 键与
键与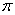 键数目之比为 。
键数目之比为 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为 ,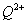 的未成对电子数是 。
的未成对电子数是 。
(3 )在
)在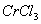 的水溶液中,一定条件下存在组成为
的水溶液中,一定条件下存在组成为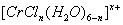 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
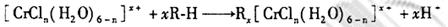
交换出来的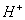 经中和滴定,即可求出x和n,确定配离子的组成。将含0.0015 mol
经中和滴定,即可求出x和n,确定配离子的组成。将含0.0015 mol 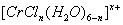 的溶液,与R-H完全交换后,中和生成的
的溶液,与R-H完全交换后,中和生成的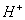 需浓度为0.1200 mol·L-1 NaOH溶液25.00 ml,该配离子的化学式为 。
需浓度为0.1200 mol·L-1 NaOH溶液25.00 ml,该配离子的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语使用正确的是( )
A.硫原子的原子结构示意图: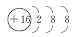
B.NH4Cl的电子式: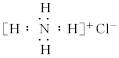
C.原子核内有10个中子的氧原子: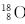
D.对氯甲苯的结构简式: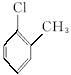
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物,按其晶体的熔点由高到低排列正确的是
A.SiO2 CsCl CBr4 CF4 B.SiO2 CsCl CF4 CBr4
C.CsCl SiO2 CBr4 CF4 D.CF4 CBr4 CsCl SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
在基态多电子原子中,关于核外电子能量的叙述错误的是
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是
A.在水溶液里,乙酸分子中的—CH3可以电离出H+
B.红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析
C.用金属钠可区分乙醇和乙醚
D.盐析可提纯蛋白质并保持其生理活性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com