
分析 (1)反应中-1价碘离子化合价升高为0价,失去1个电子,碘酸钾中+5价碘降为0价,得到5个电子,依据氧化还原反应得失电子守恒,取二者最小公倍数配平氧化剂、还原剂、氧化产物、还原产物系数,然后依据原子个数守恒配平方程式,依据方程式中电子转移情况用单线桥表示;
(2)该反应中,Fe3+生成FeO42-,铁元素失去3个电子,ClO-生成Cl-得到2个电子,依据氧化还原反应得失电子守恒和原子个数守恒规律配平方程式,依据方程式中电子转移情况用单线桥表示;
(3)反应中MnO4-成Mn2+,锰得到5个电子,NO2-生成NO3-,氮失去2个电子,依据氧化还原反应得失电子守恒和原子个数守恒规律配平方程式,依据方程式中电子转移情况用单线桥表示.
解答 解:(1)反应中-1价碘离子化合价升高为0价,失去1个电子,碘酸钾中+5价碘降为0价,得到5个电子,依据氧化还原反应得失电子守恒,二者最小公倍数为5,则碘化钾系数为5,碘酸钾系数为1,单质碘系数为3,依据原子个数守恒可知,硫酸系数为3,硫酸钾系数为3,水系数为3,方程式:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,用单线桥表示为: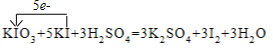 ;
;
故答案为:5 1 3═3 3 3;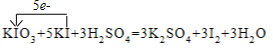 ;
;
(2)该反应中,Fe3+生成FeO42-,铁元素失去3个电子,ClO-生成Cl-得到2个电子,得失电子最小公倍数为6,根据得失电子相等结合原子个数守恒该反应方程式为 2Fe3++3 ClO-+10OH-=2FeO42-+3Cl-+5H2O,
用单线桥表示为: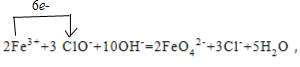
故答案为:3 2 4OH-═3 2 5;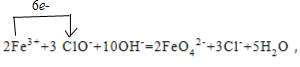 ;
;
(3)反应中MnO4-成Mn2+,锰得到5个电子,NO2-生成NO3-,氮失去2个电子,依据氧化还原反应得失电子守恒和原子个数守恒规律可知反应方程式:5NO2-+2MnO4-+6H+═5NO3-+2Mn2++3H2O,用单线桥表示为: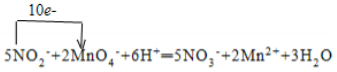 ;
;
故答案为:2 5 6 H+═2 5 3;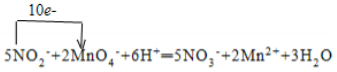
点评 本题考查了氧化还原方程式的配平及表示方法,明确氧化还原反应中得失电子守恒、原子个数守恒是解题关键,题目难度不大,注意单线桥与双线桥表示的区别.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 冰箱内放置木炭除异味 | |
| B. | 炒菜时油锅着火,立即盖上锅盖 | |
| C. | 用食醋除去水壶中的水垢 | |
| D. | 用燃着的木条检查液化石油气的泄漏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L氢气中含有氢分子数目为NA | |
| B. | 常温常压下,14g氮气含有的原子数目为NA | |
| C. | 0.5mol Na2CO3中含有的Na+数目为0.5NA | |
| D. | 0.5mol/L Fe2(SO4)3溶液中,SO42-的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ PO3- K+ CO32- | B. | Ca2+ OH- Na+ CO32- | ||
| C. | K+NO3-NH4+Cl- | D. | Cu2+ F- Zn2+ OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
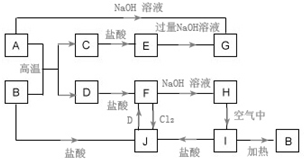
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定熔融氢氧化钠的导电性,可在氧化铝坩埚中熔化氢氧化钠固体后进行测量 | |
| B. | Fe(OH)3胶体可以将Fe Cl3滴入NaOH溶液中进行制备 | |
| C. | 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| D. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨作阳极,铁作阴极 | |
| B. | 粗铜(含Fe、Ni、Zn)作阳极,纯铜作阴极 | |
| C. | 纯铜作阳极,铁作阴极 | |
| D. | 铁作阳极,纯铜作阴极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com