
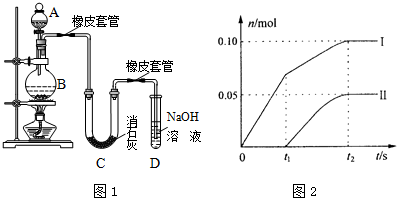
分析 (1)由仪器图形可判断仪器名称,二氧化锰和浓盐酸在加热条件下生成氯气,氯气和分别与氢氧化钙、氢氧化钠溶液反应;
(2)工业制取漂白粉的反应原理书写反应的化学方程式;
(3)在两个橡皮套管内的玻璃管口应尽量紧靠,因为氯气是强氧化剂能氧化橡胶管;
(4)①因为温度高时易生成Ca(ClO3)2,所以避免此反应发生可以采取降温措施;
a、当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,根据温度高低来判断属于哪种离子;
b、根据氧化还原反应中得失电子数相等计算氯离子的物质的量,然后根据含氯化合物中钙离子和阴离子的个数比计算氢氧化钙的物质的量;
c、另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,依据氯化钙、次氯酸钙、氯酸钙中钙离子和含氯元素的物质的量比为1:2,结合b计算得到氢氧化钙物质的量计算氯元素物质的量,依据氧化还原反应电子守恒,生成产物中氯元素守恒列式计算;
②装置中无氯气的除杂装置,挥发出的氯化氢会和氢氧化钙反应.
解答 解:(1)装置中添加浓盐酸通过分液漏斗;氯气有毒,不能排放到空气中,氢氧化钠溶液的作用是吸收过量的氯气;故答案为:分液漏斗;吸收尾气;
(2)漂白粉将在U形管中产生,是氯气和氢氧化钙反应生成氯化钙、次氯酸钙、水;其化学方程式为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
故答案为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
(3)Cl2易腐蚀橡皮塞,在两个橡皮套管内的玻璃管口应尽量紧靠,故答案为:Cl2易腐蚀橡皮塞;
(4)①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却;
a、当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,刚开始反应时,温度较低,氯气和氢氧化钙反应生成氯化钙和次氯酸钙,所以图2中曲线I表示离子ClO-的物质的量随反应时间变化的关系;
b、根据氧化还原反应中得失电子数相等计算氯离子的物质的量,设氯离子的物质的量为n,则n×1=0.10mol×1+0.05mol×5=0.35mol,含氯元素的物质的量=0.35mol+0.1mol+0.05mol=0.5mol,氯化钙、次氯酸钙、氯酸钙中钙离子和含氯离子的个数比为1:2,所以所取石灰乳中含有Ca(OH)2的物质的量为0.25mol;
c、取一份与②等物质的量的石灰乳,物质的量为0.25mol,根据氧化还原反应中得失电子数相等,生成氯离子得到电子和生成次氯酸根和氯酸根失去的电子守恒,设n(ClO-)=x,n(ClO3-)=y;则得到:①0.37=x×1+y×5;依据氯化钙、次氯酸钙、氯酸钙中钙离子和含氯元素的物质的量比为1:2,得到氯元素物质的量为0.5mol;②x+y+0.37=0.5;①②联立得到:
x=0.07mol,y=0.06mol;则n(ClO-)/n(ClO3-)=7:6;
故答案为:将U型管置于冷水浴中;ClO-;0.25;7:6;
②装置中无氯气的除杂装置,挥发出的氯化氢会和氢氧化钙反应,反应的化学方程式为:2HCl+Ca(OH)2=CaCl2+2H2O,
故答案为:2HCl+Ca(OH)2=CaCl2+2H2O.
点评 本题考查了实验室制漂白粉的装置分析和制备条件判断,为高考常见题型,侧重于学生的分析能力和实验能力的考查,温度不同产物不同,图象分析是解题关键,通过氧化还原反应的电子守恒计算应用是解题关键,实验装置和步骤的分析需要熟练掌握实验基本操作,题目难度较大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度、压强下,气体体积由其物质的量的多少决定 | |
| B. | 两种物质的物质的量相同,则它们在标准状况下的体积相同 | |
| C. | 同温同压下,气体的密度与气体的相对分子质量成正比 | |
| D. | 同温同体积时,气体物质的物质的量越大,则压强越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 58.5g NaCl含有NA个分子 | |
| B. | 1mol N2和3mol H2充分反应,有6NA电子转移 | |
| C. | 标准状况下,22.4LCHCl3含有分子数为NA | |
| D. | 46g NO2和N2O4混合气体含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
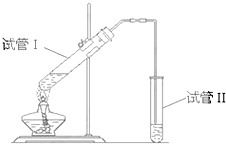 如图所示装置,该装置用于制备少量乙酸乙酯,请回答:
如图所示装置,该装置用于制备少量乙酸乙酯,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
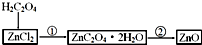
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
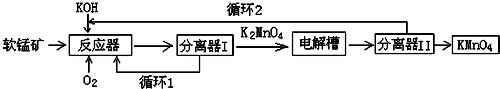
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(g.cm-3) | 水溶性 | |
| 苯甲酸 | 122 | 122.4 | 249 | 1.2659 | 微溶 |
| 甲醇 | 32 | -97 | 64.6 | 0.792 | 互溶 |
| 苯甲酸甲酯 | 136 | -12.3 | 196.6 | 1.0888 | 不溶 |
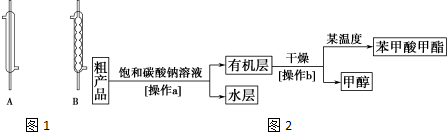
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高硫酸亚铁的溶解度 | B. | 防止硫酸亚铁分解 | ||
| C. | 抑制硫酸亚铁水解 | D. | 稀硫酸防止硫酸亚铁被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com