
| A. | 各物质的浓度之比c(A):c(B):c(C)=2:3:4 | |
| B. | 平衡混合气体中各物质的浓度相等 | |
| C. | 平衡混合气的体积是反应开始前的$\frac{4}{5}$ | |
| D. | 单位时间内,若消耗了a mol A物质,同时也消耗了2a mol C物质 |
分析 反应前后气体的体积不等,当达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量不变,可以此判断是否得到平衡状态.
解答 解:A.平衡混合物中各物质的浓度比为2:3:4不能用以判断是否达到平衡状态,与起始配料比以及反应的转化程度有关,故A错误;
B.平衡混合物中各物质的浓度相等不能判断是否达到平衡状态,与起始配料比以及反应的转化程度有关,故B错误;
C.由于起始量未知,且不知平衡常数,不能用平衡混合物的体积是反应刚开始时的$\frac{4}{5}$作为判断是否平衡的依据,故C错误;
D.单位时间内若消耗了amolA,同时也消耗了2a mol C,说明正逆反应速率相等,达到了平衡,故D正确;
故选D.
点评 本题考查化学平衡状态的判断,题目难度不大,注意把握判断的依据,把握平衡状态的实质和特征.


科目:高中化学 来源: 题型:实验题
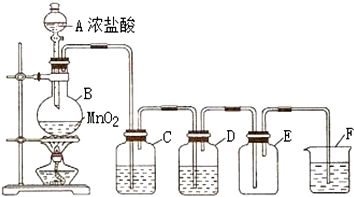
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯不能使酸性KMnO4溶液褪色 | |
| B. | 苯不能使溴水因发生化学反应而褪色 | |
| C. | 苯在加热和有催化剂存在条件下与H2反应生成环己烷 | |
| D. | 邻二氯苯只有一种结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A. | ①和②中溶质均未水解 | |
| B. | 由③④可得出酸性强弱关系:H2CO3>HF | |
| C. | ③中:c(Na+)+c(H+)=c(Fˉ)+c(OHˉ) | |
| D. | ④中:c(HCO3ˉ)+2c(CO32ˉ)+c(H2CO3)=0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物;E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题:
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物;E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题: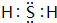 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
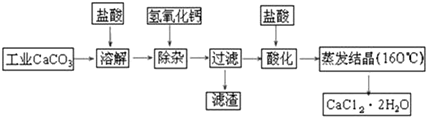
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
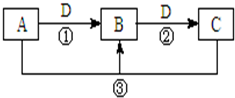 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a(A-N+3)}{A+3}$ | B. | $\frac{a(A-N+8)}{A+16}mol$ | ||
| C. | $\frac{a(2A-2N+40)}{2A+90}$ | D. | $\frac{2A-2N+24}{2A+54}mol$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com