
以下每个选项中的两组物质都能反应,且能放出同一种气体的是( )
A.铜与稀硫酸,铜与浓硫酸
B.铁与稀硫酸,铁与浓硫酸
C.硫化钠与稀硫酸,亚硫酸钠与稀硫酸
D.硫化钠与稀硫酸,硫化钠与稀盐酸
科目:高中化学 来源:2014高考化学名师知识点精编 专题21化学实验基础练习卷(解析版) 题型:实验题
化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中Na2CO3的质量分数。
【方案一】 称取一定质量的固体样品,通过加热至恒重后冷却,称量剩余固体质量,计算。
(1)下列仪器中,在灼烧固体样品时必须用到的是 (填名称)。

(2)实验中需加热至恒重的目的是: 。
(3)实验中确定加热至恒重的方法是: 。
(4)若加热过程中有晶体迸溅出来,则测得的结果 (填“偏大”、“偏小”或“不变”)。
【方案二】 称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(已知:Ba2++OH-+HC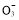
 BaCO3↓+H2O)
BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为 。
(2)实验中判断沉淀是否完全的方法是 。
(3)实验中洗涤沉淀的操作是 。
(4)实验中判断沉淀是否洗涤干净的方法是 。
【方案三】 按如图所示装置进行实验:

(1)B装置内所盛试剂是 ;D装置的作用是 ;分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9 g样品,实验后测得C装置增重8.8 g,则样品中Na2CO3的质量分数为 。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题19烃的衍生物基础营养物质练习卷(解析版) 题型:选择题
化合物M叫假蜜环菌素,它是香豆素类天然化合物。下列对化合物M的叙述中错误的是( )
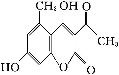 M(假蜜环菌素)
M(假蜜环菌素)
A.M的分子式为C12H10O5
B.1 mol M最多可和6mol H2发生加成反应
C.M可发生水解反应
D.M可与 HBr反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题17氮及其化合物练习卷(解析版) 题型:选择题
物质的量之比为1∶3的锌与稀硝酸混合,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法中正确的是( )
A.在此反应中硝酸体现强氧化性,全部被还原
B.向反应后的溶液中再加入金属铁,不再发生化学反应
C.该反应中被还原的硝酸与未被还原的硝酸之比为1∶4
D.该反应中被还原的硝酸与未被还原的硝酸之比为1∶5
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题16硫及其化合物练习卷(解析版) 题型:填空题
Na2S2O3·5H2O 俗称“海波”,是常用的脱氧剂、定影剂和还原剂;它是无色易溶于水的晶体,不溶于乙醇,在20 ℃ 和70 ℃ 时的溶解度分别为60.0 g 和212 g,Na2S2O3·5H2O于40~45 ℃熔化,48 ℃分解。下面是实验室制备及相关性质实验。
制备海波的反应原理:Na2SO3+S Na2S2O3
Na2S2O3
制备海波的流程:
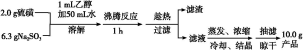
(1)实验开始时用1 mL乙醇润湿硫粉的作用是 。
A.有利于亚硫酸钠与硫磺的充分接触
B.防止亚硫酸钠溶解
C.控制溶液的pH
D.提高产品的纯度
(2)趁热过滤的原因是 。
(3)滤液不采用直接蒸发结晶的可能原因是 。
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是 。
A.无水乙醇 B.饱和NaCl溶液 C.水 D.滤液
(5)产品的纯度测定:取所得产品10.0 g,配成500 mL溶液,再从中取出25 mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050 mol/L的标准碘水溶液滴定,重复三次,平均消耗20 mL标准碘水,涉及的滴定反应方程式为:I2+2Na2S2O3 2NaI+Na2S4O6。产品中的Na2S2O3·5H2O的纯度为 %。
2NaI+Na2S4O6。产品中的Na2S2O3·5H2O的纯度为 %。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题15富集在海水的元素-氯溴碘练习卷(解析版) 题型:实验题
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:
①在酸性条件下,I-能被N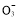 氧化成I
氧化成I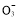 ,被H2O2或O2等氧化成I2;
,被H2O2或O2等氧化成I2;
②I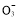 能被HS
能被HS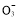 还原成I2。
还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、I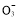 中的哪一种。
中的哪一种。
限选试剂如下:1.0 mol·L-1 HNO3溶液、1.0 mol·L-1 H2SO4溶液、1.0 mol·L-1 NaHSO3溶液、3% H2O2溶液、1%淀粉溶液、蒸馏水
Ⅰ.提出假设
假设1:该食盐样品中含I2;
假设2:该食盐样品中含I-;
假设3: 。
Ⅱ .设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表。
实验步骤 | 预期现象与结论 |
步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液振荡 | 若溶液显 ,则假设1成立;否则,假设1不成立,再进行步骤2 |
步骤2:
| 若溶液显蓝色,则假设2成立,反应的离子方程式为 ; 否则,假设2不成立,再进行步骤3 |
步骤3:
|
|
Ⅲ.问题与思考
纯的KIO3或KI都可以作为食用加碘盐中碘的来源。从化学角度来看,食盐中添加 (填“KIO3”或“KI”)更好;理由是 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题15富集在海水的元素-氯溴碘练习卷(解析版) 题型:选择题
下列能够检验出KI中是否含有Br-的实验是( )
A.加入足量的新制氯水,溶液颜色变深,则含有Br-
B.加入KMnO4酸性溶液,溶液颜色褪去,则含有Br-
C.加入少量的碘水,再加入CCl4振荡,CCl4层有色,则含有Br-
D.加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br-
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题13铁、铜及其重要化合物练习卷(解析版) 题型:选择题
根据下列框图分析,下列说法正确的是( )
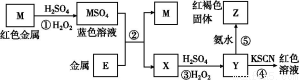
A.E3+的氧化性比M2+的氧化性弱
B.在反应①中硫酸既表现了酸性、又表现了氧化性
C.反应④的离子方程式可表示为:3SCN-+E3+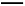 E(SCN)3↓
E(SCN)3↓
D.在③反应中若不加稀硫酸可能看到红褐色沉淀
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题10盐类水解与沉淀溶解平衡练习卷(解析版) 题型:选择题
下列叙述正确的是( )
A.浓度均为0.1 mol·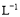 的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:
的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:
c(CH3COOH)+c(CH3COO-)=0.2 mol·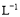
B.0.1 mol·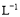 NaHCO3溶液中:c(Na+)=c(HC
NaHCO3溶液中:c(Na+)=c(HC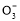 )+c(H2CO3)+2c(C
)+c(H2CO3)+2c(C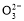 )
)
C.0.2 mol·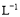 HCl溶液与等体积的0.1 mol·
HCl溶液与等体积的0.1 mol·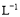 NaOH溶液混合后,溶液的pH=1
NaOH溶液混合后,溶液的pH=1
D.0.1 mol·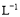 氨水中滴入0.1 mol·
氨水中滴入0.1 mol·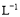 盐酸至溶液呈中性时,混合溶液中:c(N
盐酸至溶液呈中性时,混合溶液中:c(N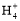 )=c(Cl-)
)=c(Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com