
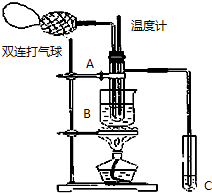
 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
分析 (1)根据乙醛与氧气发生氧化反应生成乙酸;
(2)根据实验开始时温度计应测量反应的温度,控制反应温度为60℃~80℃;根据蒸馏原理,温度计测量的是蒸气的温度;
(3)B中装的液体直接受热,可以让试管A内的反应液均匀受热发生反应,根据乙酸的沸点为117.9℃,要想通过蒸馏的方法得到乙酸,B内盛装的液体的沸点应大于117.9℃;
(4)根据乙酸能与碳酸氢钠粉末反应产生气泡,醋酸能使PH试纸变红来回答.
解答 解:(1)乙醛与氧气发生氧化反应生成乙酸,方程式为:2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH,
故答案为:2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH;
(2)实验开始时温度计应测量反应的温度,控制反应温度为60℃~80℃,所以实验开始时温度计水银球的位置应在试管A的反应液中;由蒸馏原理可知,温度计测量的是蒸气的温度,所以温度计水银球的位置应在试管A的支管口处,
故答案为:试管A的反应液中;测量反应溶液的温度;试管A的支管口处;收集含乙酸的馏分;
(3)乙酸的沸点为117.9℃,要想通过蒸馏的方法得到乙酸,B内盛装的液体的沸点应大于117.9℃,由表可知烧杯B内盛装的液体可以是乙二醇或甘油,B中装的液体直接受热,可以让试管A内的反应液均匀受热发生反应,
故答案为:使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C;乙二醇或甘油;
(4)乙酸能与碳酸氢钠粉末反应产生气泡:将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸;
乙酸能使PH试纸变红:把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成,
故答案为:方法一:将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸;
方法二:把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成.
点评 本题借助于乙酸的制备,考查了蒸馏的原理、乙酸的检验,明确实验目的、能根据乙酸性质设计实验方案是解本题的关键,试题培养了学生分析和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取25.0gCuSO4•5H2O溶于1L水中 | |
| B. | 取16.0gCuSO4•5H2O溶于水,再稀释至1L | |
| C. | 将胆矾加热失去结晶水,再取无水硫酸铜16.0g溶于1L水 | |
| D. | 取25.0gCuSO4•5H2O溶于水,再稀释配成1L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
, .
.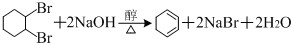 .
.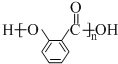 .
.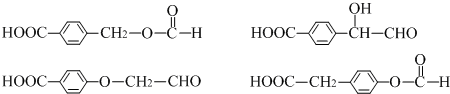 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com