
【题目】某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 | 分别进行的操作 | 现象 |
| i. 连好装置一段时间后,向烧杯中滴加酚酞 | |
ii. 连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验i中的现象是______。
②用电极反应式解释实验i中的现象:______。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是______。
②进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 试管 | 现象 |
| 0.5 mol·L-1 K3[Fe(CN)6]溶液 | iii. 蒸馏水 | 无明显变化 |
iv. 1.0 mol·L-1NaCl 溶液 | 铁片表面产生大量蓝色沉淀 | ||
v. 0.5 mol·L-1Na2SO4溶液 | 无明显变化 |
a. 以上实验表明:在有______存在条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b. 为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是______。
(3)有同学认为上述实验仍不够严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是______(填字母序号)。
实验 | 试剂 | 现象 |
A | 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
B | 酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2) | 产生蓝色沉淀 |
C | 铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2) | 产生蓝色沉淀 |
D | 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2) | 产生蓝色沉淀 |
(4)综合以上实验分析,利用实验ii中试剂能证实铁发生了电化学腐蚀的实验方案是:连好装置一段时间后,取铁片(负极)附近溶液于试管中,_____(回答相关操作、现象),则说明负极附近溶液中产生了Fe2+,即发生了电化学腐蚀。
【答案】 碳棒附近溶液变红 O2+4e-+2H2O === 4OH- K3[Fe(CN)6]可能氧化Fe生成Fe2+,会干扰由于电化学腐蚀负极生成Fe2+的检验 Cl- Cl-破坏了铁片表面的氧化膜 AC 滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀
【解析】试题分析: (1).连好装置构成原电池,铁是负极,电极反应是![]() ,碳棒是正极,电极反应是
,碳棒是正极,电极反应是![]() ;(2)①K3[Fe(CN)6]具有氧化性,K3[Fe(CN)6]可能氧化Fe生成Fe2+;a.根据实验iii可知单纯K3[Fe(CN)6]不与铁反应、根据实验 Iv可知有氯化钠存在时,K3[Fe(CN)6]与铁反应、根据实验v可知,在有硫酸钠存在时K3[Fe(CN)6]不与铁反应;b、将铁片用酸洗涤,破坏铁表面的氧化膜; 氧气能把铁氧化为Fe2+、盐酸能把铁氧化为Fe2+;(4)取铁片附近溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则证明铁发生了电化学腐蚀。
;(2)①K3[Fe(CN)6]具有氧化性,K3[Fe(CN)6]可能氧化Fe生成Fe2+;a.根据实验iii可知单纯K3[Fe(CN)6]不与铁反应、根据实验 Iv可知有氯化钠存在时,K3[Fe(CN)6]与铁反应、根据实验v可知,在有硫酸钠存在时K3[Fe(CN)6]不与铁反应;b、将铁片用酸洗涤,破坏铁表面的氧化膜; 氧气能把铁氧化为Fe2+、盐酸能把铁氧化为Fe2+;(4)取铁片附近溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则证明铁发生了电化学腐蚀。
解析: (1).连好装置构成原电池,铁是负极,电极反应是![]() ,碳棒是正极,电极反应是
,碳棒是正极,电极反应是![]() ,所以实验i中的现象是碳棒附近溶液变红;(2)①K3[Fe(CN)6]具有氧化性,K3[Fe(CN)6]可能氧化Fe生成Fe2+,会干扰由于电化学腐蚀负极生成Fe2+的检验;a.根据实验iii可知单纯K3[Fe(CN)6]不与铁反应、根据实验 Iv可知有氯化钠存在时,K3[Fe(CN)6]与铁反应、根据实验v可知,在有硫酸钠存在时K3[Fe(CN)6]不与铁反应,所以以上实验表明:在有Cl-存在条件下,K3[Fe(CN)6]溶液可以与铁片发生反应,b、补充实验表明Cl-的作用是破坏了铁片表面的氧化膜;(3)将铁片用酸洗涤,破坏铁表面的氧化膜; 氧气能把铁氧化为Fe2+、盐酸能把铁氧化为Fe2+;所以能证实以上影响确实存在的是AC;(4)取铁片附近溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则证明铁发生了电化学腐蚀。
,所以实验i中的现象是碳棒附近溶液变红;(2)①K3[Fe(CN)6]具有氧化性,K3[Fe(CN)6]可能氧化Fe生成Fe2+,会干扰由于电化学腐蚀负极生成Fe2+的检验;a.根据实验iii可知单纯K3[Fe(CN)6]不与铁反应、根据实验 Iv可知有氯化钠存在时,K3[Fe(CN)6]与铁反应、根据实验v可知,在有硫酸钠存在时K3[Fe(CN)6]不与铁反应,所以以上实验表明:在有Cl-存在条件下,K3[Fe(CN)6]溶液可以与铁片发生反应,b、补充实验表明Cl-的作用是破坏了铁片表面的氧化膜;(3)将铁片用酸洗涤,破坏铁表面的氧化膜; 氧气能把铁氧化为Fe2+、盐酸能把铁氧化为Fe2+;所以能证实以上影响确实存在的是AC;(4)取铁片附近溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则证明铁发生了电化学腐蚀。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:
【题目】鉴别苯酚溶液、己烷、己烯、乙酸溶液和乙醇液体,可选用的最佳试剂是( )
A.溴水、Cu(OH)2
B.FeCl3溶液、金属钠、溴水、石蕊试液
C.石蕊试液、溴水
D.KMnO4酸性溶液、石蕊试液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一反应:2A+B2C,其中A、B、C均为气体,如图的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,则下列描述正确的是( ) 
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点若要达到平衡,可以采取增大压强的方法
D.c点时v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液 (二甲胺在水中的电离与氨相似,在常温下Kb[(CH3)2NH·H2O]=1.6×10-4 )。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
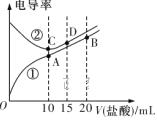
A. D点溶液中:2c(Na+)=3c(Cl-)
B. A点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
C. 曲线②代表滴定二甲胺溶液的曲线
D. 在相同温度下,A、B、C、D四点的溶液中,水的电离程度最大的是C点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示。CH3—CH=CH-CH3可简写为![]() 。有机物X的键线式为:
。有机物X的键线式为: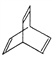
(1)有机物X的分子式为_____________;
(2)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有_________种;
(3)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式______________________;
(4)有机物Y使溴水褪色,写出可能发生的化学方程式:_________________________________;
(5)Y与乙烯在一定条件下发生等物质的量聚合反应,写出其反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物体的生命活动离不开水,下列关于水的叙述,错误的是( )
A. 在最基本生命系统中,H2O有自由水和结合水两种存在形式
B. 由氨基酸形成多肽链时,生成物H2O中的氢来自氨基和羧基
C. 有氧呼吸时,生成物H2O中的氢来自线粒体中丙酮酸的分解
D. H2O在光下分解,产生的[H]将固定的CO2还原成(CH2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积固定的密闭容器中加入反应物A,B,发生如下反应:A+2B3C.反应经2min后,A的浓度从开始时的1.0mol/L降到0.8mol/L.已知反应开始时B的浓度是0.8mol/L, 求:
(1)2min末B,C的浓度;
(2)2min内C的平均化学反应速率;
(3)2min末时物质B的转化率.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com