
【题目】下列实验方案可行的是( )
A.加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
B.用BaCl2除去NaOH溶液中混有的少量Na2SO4
C.将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2
D.用溶解、过滤的方法分离CaCl2和NaCl固体混合物
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】已知:常温下,0.01 mol·L-1 MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱稀溶液反应的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A.-69.4 kJ·mol-1
B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1
D.+45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学平衡一定发生移动的是( )
A. 平衡混合物中各组分的浓度发生改变 B. 正、逆反应速率发生改变
C. 组分中某物质的转化率发生改变 D. 体系的压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现某药物M能治疗心血管疾病是因为它在人体内能释放出一种“信使分子”D,并阐明了D在人体内的作用原理。为此他们荣获了1998年诺贝尔生理学或医学奖。
请回答下列问题:
(1)已知M的相对分子质量为227,由C、H、O、N四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%。则M的分子式是______________。D是双原子分子,相对分子质量为30,则D的分子式为______________。
(2)油脂A经下列途径可得到M。

图中②的提示: ![]()
反应①的反应类型是_________________。 反应②的化学方程式是 ________________。
(3)C是B和乙酸在一定条件下反应生成的化合物,分子量为134,写出C一种可能的结构简式:________________________________。
(4)若将0.15 mol B与足量的金属钠反应,则需消耗___________g金属钠。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种有机化合物A.C2H4 B.![]() C.CH2=CH-CH=CH2 D.HOOCCH2CH2CH2Cl
C.CH2=CH-CH=CH2 D.HOOCCH2CH2CH2Cl
(1)C与Br2按物质的量之比1∶1反应后的产物是_________、_____________
(2)B的分子式是_________
(3)下列有关叙述正确的是_________
A.C可能的加聚产物是![]()
B.D中的官能团名称分别是酸基、氯原子
C.B能使酸性KMnO4溶液褪色
D.A生成的聚合物的链节是—CH2-CH2—
(4)D经过三步反应生成五元环酯,
HOOCCH2CH2CH2Cl![]() E
E![]() F
F![]()
![]()
则E的结构简式_________,F生成五元环酯的化学方程式______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答下列问题:
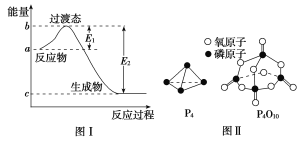
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是__________________________。
请写出NO2和CO反应的热化学方程式:______________________________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)
ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)===CO2(g)+2H2(g)
O2(g)===CO2(g)+2H2(g)
ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为______________________________。
(3)下表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O===O | P===O |
键能/(kJ·mol-1) | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=________kJ·mol-1(用含a、b、c、d的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )

A. 丙与戊的原子序数相差28
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,庚和乙形成的化合物易溶于水
D. 丁的最高价氧化物不与任何酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,下列说法正确的是( )
CH3COO-+H+,下列说法正确的是( )
A. 向10mLpH=5的CH3COOH溶液中加水至10L,最后溶液pH在7和8之间
B. 加入少量CH3COONa固体,平衡向左移动,c(CH3COO-)下降
C. 加入少量NaOH固体(忽略溶解热效应),平衡向右移动,水的电离程度也随之增大
D. 向10mLpH=5的CH3COOH溶液中加入等体积,等浓度的盐酸,混合溶液的c(H+)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com