
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是( )

A.W点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B.pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)<0.1mol·L-1
C.pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-)
D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3)
【答案】B
【解析】A、W点所示的溶液呈电中性,即c(正电荷) = c(负电荷),则c(Na+) + c(H+) = 2 c(CO32-) + c(HCO3-) + c(OH-) + c(Cl-),不能漏了碳酸氢根离子所带负电荷浓度,A错误;B、由物料守恒原理可知,c(H2CO3) + c(HCO3-) + c(CO32-) + c(CO2) = 0.1 mol·L-1,由于饱和碳酸的pH=5.6,则pH = 4的溶液中已经逸出部分CO2,则c(H2CO3) + c(HCO3-) + c(CO32-) < 0.1 mol·L-1,B正确;C、由电荷守恒原理可得:c(Na+) + c(H+) = 2 c(CO32-) + c(HCO3-) + c(OH-) + c(Cl-),由物料守恒原理可得:c(Na+) = 2 c(H2CO3) + 2 c(HCO3-) + 2 c(CO32-),则2 c(H2CO3) + 2 c(HCO3-) + 2 c(CO32-) + c(H+) = 2 c(CO32-) + c(HCO3-) + c(OH-) + c(Cl-),即2 c(H2CO3) + c(HCO3-) + c(H+) = c(OH-) + c(Cl-),不能漏了H2CO3浓度的2倍,C错误;D、根据图像可知pH=11时,Na2CO3的浓度远远大于NaHCO3,说明反应Na2CO3+HCl=NaCl+NaHCO3中参加反应的Na2CO3较少,过量的Na2CO3较多,由过量的Na2CO3及等量NaCl、NaHCO3的电离及NaHCO3的水解规律可知,c(Na+) > c(CO32-) > c(Cl-) > c(HCO3- ) > c(H2CO3),D错误;答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1
FeO(s)+CO(g) ΔH1,平衡常数为K1
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
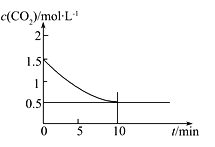
①该条件下反应的平衡常数为___________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时![]() 增大的是__________(填序号) 。
增大的是__________(填序号) 。
A.升高温度 B.增大压强 C.再充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母)。
a.容器中的压强不变
b.气体的密度不再改变
c.v正(CO2)=v逆(CO)
d.c(CO2)=c(CO)
e.容器内气体总物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用离子方程式 CO32﹣+2H+=CO2↑+H2O表示的反应是
A.Na2CO3+2HCl=2NaCl+CO2↑+H2O
B.K2CO3+2HNO3=2KNO3+CO2↑+H2O
C.K2CO3+H2SO4=K2SO4+CO2↑+H2O
D.CaCO3+2HCl=CaCl2+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用下面所示装置制取氯酸钾、次氯酸钠和氯水并进行探究实验。

实验I.制取氮酸钾、次氯酸钠和氯水
(1)写出装置A实验室制取Cl2的化学反应方程式________________________________。
(2)制取实验结束后,取出装置B中的试管,冷却结晶、过滤、洗涤,该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、_________、_________。为提高氯酸钾和次氯酸钠的产率,在实验装置中还需要改进的是_________。
(3)装置 C 中反应需要在冰水浴中进行,其原因是________________________________。
(4)装置D中的实验现象是溶液先变红后褪色,最后又变为_________色。
实验Ⅱ 尾气处理
实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响)
①提出合理假设
假设1:只存在SO32- ;假设2:既不存在SO32-也不存在ClO-;假设 3:_________。
②设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3mol/L H2SO4、1mol/LNaOH 溶液、0.01mol/L 酸性 KMnO4 溶液、淀粉 KI 溶液。
实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液分置于A、B试管中 | |
步骤2:向A试管中滴加0.01mol/L酸性 | (1)若溶液褪色,则假设1成立 |
KMnO4溶液 | (2)若溶液不褪色,则假设2或3成立 |
步骤3:_____ | _____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作或现象与实验结论都正确的是
选项 | 实验操作或现象 | 实验结论 |
A. | 铜和浓硝酸反应制备NO2;二氧化锰与浓盐酸反应制备Cl2 | 均有电子转移 |
B. | 向沸水中滴加氯化铁溶液制氢氧化铁胶体;蛋白质在酶的作用下生成氨基酸 | 水均作氧化剂 |
C. | SO2使品红溶液褪色;乙烯使溴水褪色 | SO2与乙烯 均表现漂白性 |
D. | 用pH试纸测定纯碱溶液的pH;用淀粉KI试纸检验O3 | 试纸均需湿润 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2molSO2和1molO2分别置于相同体积的甲乙两密闭容器中发生反应2SO2+O2(g)![]() 2SO3(g),并达到平衡。在这过程中,甲容器保持恒温恒容,乙容器保持恒温恒压,达到平衡时,下列说法正确的是( )
2SO3(g),并达到平衡。在这过程中,甲容器保持恒温恒容,乙容器保持恒温恒压,达到平衡时,下列说法正确的是( )
A.达到平衡所需的时间为:甲>乙 B.甲的转化率>乙的转化率
C.混合气体中SO3的含量为:甲>乙 D.气体的总物质的量:甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喷泉实验是一种常见的自然现象,其产生原因是存在压强差。试根据下图,回答下列问题:
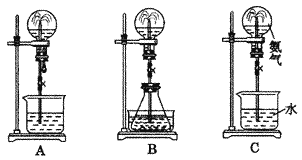
(1)在图A的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是_______
A.HCl和H2O B.NH3和H2O C.NH3和CCl4 D.CO2和NaOH溶液
(2)在图B的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是_______
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
(3)在图B的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质不可能是_______
A.浓硫酸 B.生石灰 C.硝酸铵 D.烧碱
(4)比较图A和图B两套装置,以产生喷泉的原理来分析,图A是_______上部烧瓶内压强;图B是_______下部锥形瓶的压强(填“增大”或“减小”)。
(5)如果只提供如图C的装置,引发喷泉的方法是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2015天津]下列有关“化学与生活”的叙述不正确的是
A.点燃爆竹后,硫燃烧生成SO3
B.中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
C.服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒
D.使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com