
| 选项 | 实验目的 | 实验设计 |
| A | 证明Ksp(AgCl)>Ksp(AgI) | 往AgCl悬浊液中滴入几滴KI溶液 |
| B | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硝酸 |
| C | 检验溶液中是否含有Fe2+ | 向溶液中滴入氯水后,再滴加KSCN溶液 |
| D | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、使酚酞溶液变红的溶液:Na+、Cl-、NO3-、Ba2+ |
| B、澄清透明的无色溶液:MnO4-、Al3+、OH-、Cu2+ |
| C、使紫色石蕊溶液变红的溶液:K+、Mg2+、Cl-、NO3- |
| D、与金属反应产生氢气的溶液:CO32-、SO42-、Na+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+═2Cl-+2Fe3+ |
| B、大理石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| D、为了除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理:Ca2++CO32-═CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3?H2O溶液,滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3?H2O溶液,滴定曲线如图.下列说法正确的是( )| A、①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) |
| B、②溶液:c(NH4+)=c(C1-)>c(OH-)=c(H+) |
| C、③溶液:c(OH-)>c(H+) |
| D、滴定过程中可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol | B、4mol |
| C、6mol | D、8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、吸引电子能力的大小顺序一定为Z>Y>W |
| B、原子半径的大小顺序一定为X>Y>Z>W |
| C、Y、Z形成的分子的空间构型可能是正四面体 |
| D、原子核外未成对电子数可能是Z>Y>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应的速率不同,但是产生的氢气的体积相同.在如图装置中的锥形瓶中分别装入l mol.L-1的盐酸和醋酸各10mL,进行实验.
某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应的速率不同,但是产生的氢气的体积相同.在如图装置中的锥形瓶中分别装入l mol.L-1的盐酸和醋酸各10mL,进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:
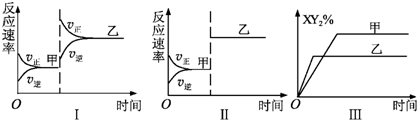
| A、图Ⅰ由甲至乙加入适当催化剂 |
| B、图Ⅱ由甲至乙扩大容器体积 |
| C、图Ⅲ由甲至乙增大压强 |
| D、图Ⅲ由甲至乙升高温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com