
| A. | 1.7 g羟基(-OH)中含有的电子数为NA | |
| B. | 标准状况下,11.2 L CCl4含有的碳原子数为0.5NA | |
| C. | 1 mol苯分子中含有的碳碳双键数为3NA | |
| D. | 常温下,28g乙烯中含有的碳原子数为2NA |
分析 A、依据n=$\frac{m}{M}$,羟基(-OH)是中性原子团含有9个电子;
B、标准状况四氯化碳不是气体;
C、苯分子中无碳碳双键;
D、依据n=$\frac{m}{M}$计算CH2物质的量,得到碳原子数.
解答 解:A、依据n=$\frac{m}{M}$,羟基(-OH)是中性原子团含有9个电子,1.7 g羟基(-OH)物质的量=$\frac{1.7g}{17g/mol}$=0.1mol,含有的电子数为0.9NA,故A错误;
B、标准状况四氯化碳不是气体,11.2 L CCl4含有物质的量不是0.5mol,故B错误;
C、苯分子中无碳碳双键,故C错误;
D、依据n=$\frac{m}{M}$计算C2H4物质的量=$\frac{28g}{28g/mol}$=1mol,含有的碳原子数为2NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的分析应用主要是气体摩尔体积的应用条件分析判断,物质的量计算微粒数的方法,掌握基础是关键,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 使用清洁能源是防止酸雨发生的重要措施之一 | |
| B. | CO2是造成酸雨发生的罪魁祸首 | |
| C. | NO2是造成光化学烟雾的气体 | |
| D. | 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧张 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在三种元素中,元素Z的非金属性最强 | |
| B. | 气态氢化物的还原性按X、Y、Z的顺序逐渐增强 | |
| C. | Y元素一定是硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;该元素位于第三周期,第ⅢA族.
;该元素位于第三周期,第ⅢA族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
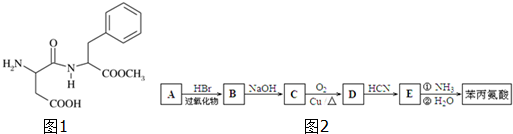
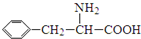 )是合成APM的原料之一.苯丙氨酸的一种合成途径如图2所示:
)是合成APM的原料之一.苯丙氨酸的一种合成途径如图2所示: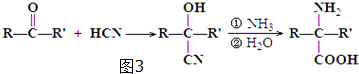
 .
.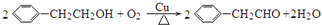 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )| A. | 铜电极附近观察到黄绿色气体 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 铜电极上发生还原反应 | D. | 溶液中的Na+向石墨电极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com