
【题目】将一小块铝片加入某盐酸溶液中,铝片完全溶解,在所得溶液中继续滴加NaOH溶液。生成Al(OH)3的量与加入的NaOH溶液体积的变化关系如图所示,下列说法正确的是( )
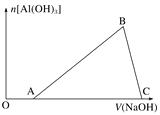
A. C点的溶质只有NaAlO2
B. 图中B点之前发生的离子反应为Al3++3OH-===Al(OH)3↓
C. A→B段消耗的NaOH溶液体积与B→C段消耗的NaOH溶液体积比=3∶1
D. 溶解铝片的盐酸浓度与滴加的NaOH溶液浓度相等
【答案】C
【解析】在O→A段,还发生了H++OH-=H2O的反应,AB段生成氢氧化铝:Al3++3OH-=Al(OH)3↓,BC段溶解氢氧化铝:Al(OH)3+OH-=AlO2-+2H2O。
A、OB段均生成NaCl,留在溶液中,C点的溶质有NaAlO2和NaCl,故A错误;B、图中B点之前发生的离子反应为H++OH-=H2O和Al3++3OH-=Al(OH)3↓,故B错误;C、A→B段Al3++3OH-=Al(OH)3↓消耗的NaOH溶液体积为3份,与B→C段Al(OH)3+OH-=AlO2-+2H2O消耗的NaOH溶液体积为1份,体积比=3∶1,故C正确;D、溶解铝片的盐酸浓度与滴加的NaOH溶液浓度,根据题目提供条件,无法判断盐酸与NaOH溶液浓度的关系,故D错误;故选C。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O下列关于该电池工作时说法正确的是( ) 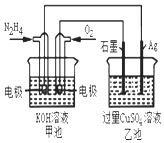
A.甲池中负极反应为:N2H4﹣4e﹣═N2+4H+
B.甲池溶液pH不变,乙池溶液pH减小
C.反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗2.24L O2 , 此时乙池中理论上最多产生12.8g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
(1)该反应是反应(填“吸热”、“放热”).
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”、“减小”、“不变”),原因是
(3)反应体系中加入催化剂对反应热是否有影响?(填“有”、“无”),原因是 .
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 , E2(填“增大”、“减小”、“不变”). 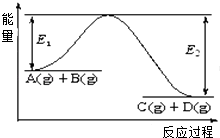
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( ) 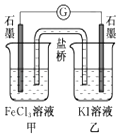
A.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
B.标准状况下,2.24LCCl4分子中共价键的数目为0.4×6.02×1023
C.控制适合的条件,将反应2Fe3++2I﹣═2Fe2++I2设计成如图所示的原电池.当电流汁读数为零后,在甲中溶入FeCl2固体,则乙中石墨电极为负极
D.向盛有2mL饱和H2S溶液的两支试管中分别滴加1滴浓度均为0.1mol/L的ZnSO4溶液和CuSO4溶液,有CuS生成而无ZnS生成,则Ksp(CuS)<Ksp(ZnS)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,①和②为两个体积相同的固定容器,图中“![]() ”和“
”和“![]() ”分别表示氢原子和氧原子,则下列说法正确的是( )
”分别表示氢原子和氧原子,则下列说法正确的是( )

A. 若①中的H2为1 mol,则②中所含原子总数为3.01×1023个
B. ①和②中气体的质量之比为1∶8
C. H2、O2均能发生化合反应,但不能发生置换反应
D. 两容器的温度和压强均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z,W均为短周期元素,它们在元素周期表中的位置如下图所示.若Y原子的最外层电子数是次外层电子数的2倍,下列说法中正确的是( ) ![]()
A.氢化物稳定性:X>Y
B.最高价氧化物对应的水化物的酸性:W>Y
C.4种元素的单质中,W单质的熔、沸点最高
D.干燥的W单质具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式为:
1)C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol
2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=﹣870.3kJ/mol
3)H2(g)+ ![]() O2(g)=H2O(l)△H3=﹣285.8kJ/mol
O2(g)=H2O(l)△H3=﹣285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为( )
A.+488.3kJ/mol
B.﹣488.3kJ/mol
C.﹣244.15kJ/mol
D.+244.15kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.
(1)冶炼铜的反应为:8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号).若反应中生成了标况下22.4L气体,转移的电子数目为________。
(2)上述冶炼过程产生大量酸性氧化物SO2,为大气污染物之一。下列处理方案中合理的是________(填代号).
a.高空排放 b.用浓硫酸氧化吸收制硫酸
c.用NaOH溶液吸收制Na2SO3 d.用氨水吸收制氮肥铵盐
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O![]() +2I-=2SO
+2I-=2SO![]() +I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.________、________(不必配平)。
+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.________、________(不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
据以上信息回答下列问题:
a.除去Al3+的离子方程式是________.
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水 所选试剂为________.证明炉渣中含有FeO的实验现象为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度不同压强(P1>P2)下,可逆反应2X(g)2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(Z%)与反应时间(t)的关系有以下图示,正确的是( )
A.
B.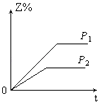
C.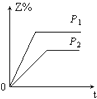
D.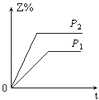
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com