
| A、碳化铝,黄色晶体,熔点2200℃.熔融态不导电 |
| B、溴化铝,无色晶体,熔点98℃,熔融态不导电 |
| C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙铜中 |
| D、干冰,无色晶体,熔融时不导电 |


科目:高中化学 来源: 题型:
| A、加入适量的NaOH |
| B、加入适量的水 |
| C、通入适量的SO2 |
| D、加入适量CuSO4固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性:FeCl3>Cl2>H2SO4>I2 |
| B、还原性:SO2>HI>FeCl2>HCl |
| C、2Fe+3I2=2FeI3 |
| D、6FeI2+3Cl2=2FeCl3+4FeI3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水与盐酸反应 |
| B、向醋酸溶液中加入适量NaOH溶液 |
| C、稀硫酸与Ba(OH)2溶液反应 |
| D、NaOH溶液与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、电池的负极反应式为:ClO-+H2O+2e-═Cl-+2OH- |
| B、当有0.1 mol Al完全溶解时,流经电解液的电子数为1.806×1023个 |
| C、往滤纸上滴加酚酞试液,b极附近颜色变红 |
| D、b极附近会生成蓝色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑤ |
| C、①②④ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g) 十H2O (g)?CO2(g) 十 H2 (g);△H<0
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g) 十H2O (g)?CO2(g) 十 H2 (g);△H<0| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:
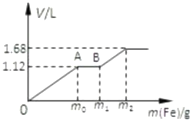 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com