
水热法制备Fe3O4纳米颗粒的反应是3Fe2+ + 2S2O32- + O2 + xOH— = Fe3O4 + S4O62 + 2H2O,关于该反应下列说法中正确的是( )
A.H2O和S4O62- 都是还原产物 B.Fe2+和S2O32-都是还原剂
C.1mol Fe2+被氧化时,转移2mol电子 D.x = 2
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源:2016-2017学年河北省高二上9.21周考化学卷(解析版) 题型:计算题
已知反应FeO(s)+CO(g)  Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始浓度c(CO)=0.05 mol·L-1,c(CO2)=0.01 mol·L-1,请回答:
Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始浓度c(CO)=0.05 mol·L-1,c(CO2)=0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
(3)增加FeO的量,对平衡有无影响?
查看答案和解析>>
科目:高中化学 来源:2017届四川省、温江中学等五校高三上第一次联考化学卷(解析版) 题型:选择题
下列化工生产过程中,未涉及氧化还原反应的是
A.海带提碘 B.氯碱工业 C.氨碱法制纯碱 D.海水提溴
查看答案和解析>>
科目:高中化学 来源:2017届四川省广元市苍溪县高三零诊理综化学试卷(解析版) 题型:选择题
在10 L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C 物质的量与时间的关系如图甲,C的百分含量与温度的关系如图乙。下列分析不正确的是( )
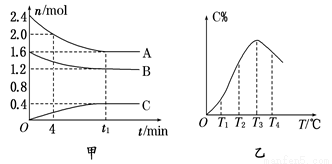
A.0~4 min时,A的平均反应速率为0.02 mol·L-1·min-1
B.该反应的平衡常数表达式K=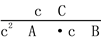
C.由T1向T2变化时,正反应速率大于逆反应速率
D.该反应正反应是放热反应
查看答案和解析>>
科目:高中化学 来源:2017届山东省淄博市高三上学期第一次月考化学试卷(解析版) 题型:填空题
铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈(CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作___________剂。
(2)自然界Cr主要以+3价和+6价(Cr2O7-)存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出离子方程式:__________________
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:

 ①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是____________。
④为测定NiSO4·xH2O晶体中x的值,称取26.3 g晶体加热至完全失去结晶水,剩余固体15.5 g,计算x的值等于 。
查看答案和解析>>
科目:高中化学 来源:2017届山东省淄博市高三上学期第一次月考化学试卷(解析版) 题型:选择题
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是( )
A.化合物KCrO2中Cr元素为+3价
B.实验①证明Cr2O3是两性氧化物
C.实验②证明H2O2既有氧化性又有还原性
D.实验③证明氧化性:Cr2O >I2
>I2
查看答案和解析>>
科目:高中化学 来源:2017届山东省淄博市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.氢氧燃料电池工作时,1mol H2在正极上失去2mol电子
B.0.1mol/LNa2CO3溶液加热后,溶液的CO32-的数目小于6.02×1022个
C.常温常压下,22.4LCl2中含有的分子数为6.02×1023个
D.室温下,稀释0.1mol/LCH3COOH溶液,溶液的导电能力减弱
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高一上第一次月考化学试卷(解析版) 题型:选择题
下列实验操作中正确的是
A. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
B. 应使混合物中的水分完全蒸干后,才能停止加热
C. 分液操作时,下层液体从分液漏斗下口放出后再将上层液体从下口放出到另一个烧杯中
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期9月月考化学试卷(解析版) 题型:填空题
A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)实验室常用A的饱和溶液制备微粒直径为1nm – l00nm的红褐色液相分散系。则该反应的化学方程式为:____________________,将A 的溶液加热蒸干并灼烧,得到固体的化学式为:________。
(2)B为地壳中含量最高的金属元素的氯化物,向50.0mL,6mol/L的B溶液中逐滴滴入100ml 某浓度的KOH溶液,若产生7.8g白色沉淀,则加入的KOH溶液的浓度可能为________________。
(3)将A、B中两种金属元素的单质用导线连接,插入一个盛有KOH溶液的烧杯中构成原电池,则负极发生的电极反应为:_______________________。
(4)完成以下氧化还原反应方程式:
( )Pt +( )HNO3 +( )HCl =( ) H2PtCl6+( )NO + _______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com