
向一定量的Fe、FeO、Fe2O3的混合物中加入120mL4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24 mol B.0.21 mol C.0.16 mol D.0.14 mol
科目:高中化学 来源: 题型:
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

 (1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
 (用a、b 表示)。
(用a、b 表示)。
 (2)负极反应式为 。
(2)负极反应式为 。
 (3)电极表面镀铂粉的原因为 。
(3)电极表面镀铂粉的原因为 。
 (4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
 Ⅰ.2Li+H2
Ⅰ.2Li+H2 LiH
LiH Ⅱ.LiH+H2O==LiOH+H2↑
Ⅱ.LiH+H2O==LiOH+H2↑
 ①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
 ②已知LiH固体密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
②已知LiH固体密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
 ③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L密闭容器中发生反应N2+3H2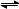 2NH3,经一段时间后NH3的物质的量增加了2.4 mol,这段时间内用氢气表示的反应速率为0.6mol/(L·s),则这段时间为 ( )
2NH3,经一段时间后NH3的物质的量增加了2.4 mol,这段时间内用氢气表示的反应速率为0.6mol/(L·s),则这段时间为 ( )
A. 6 s B. 4 s C. 3 s D. 2 s
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在pH=1的溶液中:K+、Na+、SO42–、HCO
B.在0.1 mol·L-1 Na2CO3溶液中:Al3+、K+、NO 、SO42–
、SO42–
C.在0.1 mol·L-1 FeCl3溶液中:K+、NH 、I-、SCN-
、I-、SCN-
D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
| A. | B. | C. | D. |
| 通电一段时间后,搅拌均匀,溶液的pH增大 | 甲电极上的电极反应为: 2Cl- -2e- = Cl2↑ | Pt电极上的电极反应为:O2+2H2O+4e-==4OH- | 总反应的离子方程式为: 2Fe3++Cu=Cu2++ 2Fe2+ |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的最外层电子数与次外层相等, X、Z位于同主族,Y、Z、R、T位于同周期, R最外层电子数为次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法不正确的是
A.原子半径:Y>Z>R>T
B.气态氢化物的稳定性:W<R<T
C.最高价氧化物对应的水化物碱性:X>Y>Z
D.XR2、WR2两化合物中R的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
在理论上不能用于设计原电池的化学反应是
A. 2FeCl3(aq)+2KI(aq) = 2FeCl2(aq)+2KCl(aq)+I2(aq) △H <0
B. Ba(OH)2·8H2O(s)+2NH4Cl(s) = BaCl2(aq)+2NH3·H2O(aq)+8H2O(1) △H >0
C. 4Al(s)+ 6H2O(1)+ 3O2(g)==4Al(OH)3(s) △H <0
D. Zn(s)+2MnO2(s)+2H2O(1) = 2MnOOH(s) +Zn(OH)2(s) △H <0
查看答案和解析>>
科目:高中化学 来源: 题型:
等质量的两份锌粉a、b分别加入到两份相同体积相同物质的量浓度且过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,下列各图为产生H2的体积v(L)与时间t(min)的关系,其中正确的是

查看答案和解析>>
科目:高中化学 来源: 题型:
下列烷烃在光照下与氯气反应,只能生成一种一氯代烃的是
A. CH3CH3 B. CH3CH2CH3 C. CH3CH2CH2CH3 D. CH3CH2 CH2CH2CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com