
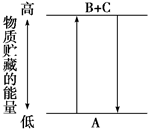
| A.A→B+C和B+C→A两个反应吸收或放出的能量数值不相等 |
| B.A→B+C是放热反应 |
| C.A具有的能量高于B和C具有的能量总和 |
| D.A→B+C是吸热反应,则B+C→A必然是放热反应 |
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源:不详 题型:单选题
| A.①②③④⑤ | B.②④ | C.①③④⑤ | D.② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.对于反应2H2O2="=2H2O+O2↑," 加入MnO2或升高温度都能加快O2生成速率 |
| B.制氧气平均速率0.01mol/L·min,要制取500mL氧气(密度1.28g/L)需时间4min |
| C.根据化学反应中的热效应将反应分为放热反应和吸热反应 |
| D.氢氧燃料电池发电,比氢气直接在空气中燃烧能量转换率高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.H2O(g)===H2O(l) ΔH=-44.0 kJ/mol |
| B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ/mol |
| C.形成化学键时共放出862 kJ能量的化学反应 |
| D.能量变化如图所示的化学反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增大反应物的浓度,活化分子百分数增加,反应速率加快? |
| B.增大气体反应体系的压强,单位体积中活化分子数增多,气体反应速率加快 |
| C.升高反应的温度,活化分子百分数增加,有效碰撞的几率提高,反应速率增大 |
| D.催化剂通过改变反应路径,使反应所需的活化能降低,反应速率增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.相同条件下,导电性强的溶液比导电性弱的溶液中自由移动离子数目多 |
| B.由C(石墨)→C(金刚石)△H= +11.9kJ·mol—1可知,金刚石比石墨稳定 |
| C.在AgNO3溶液中加入过量的稀盐酸后,溶液中不存在Ag+ |
| D.任何一个化学变化都伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol |
| C.温度、浓度的改变一定会引起反应速率的改变,所以化学平衡一定会移动 |
| D.酸与碱恰好完全反应生成正盐的c(H+)=c(OH-)=10-6 mol/L的溶液一定呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com