
����Ŀ����ɣ��׳�������й�����������Ʒ��֮һ��ijͬѧ�������·��������Բⶨ���ƿ���ݻ�����![]() NaCl������뵽500mL�ձ��У�����200mL����ˮ����NaCl��ȫ�ܽ����Һ
NaCl������뵽500mL�ձ��У�����200mL����ˮ����NaCl��ȫ�ܽ����Һ![]() ����ϴ��Һ
����ϴ��Һ![]() ȫ��ת�Ƶ���ƿ�У�������ˮϡ������ȫ��������������ȡ��100mL��Һ������Һǡ������10mL
ȫ��ת�Ƶ���ƿ�У�������ˮϡ������ȫ��������������ȡ��100mL��Һ������Һǡ������10mL![]() ��
��![]() ��Һ��ȫ��Ӧ��������˵����ȷ���ǣ� ��
��Һ��ȫ��Ӧ��������˵����ȷ���ǣ� ��
A.�����ƿ���ݻ�ԼΪ![]()
B.�����£������ƿ����������56kg![]()
C.���³�ѹ�£������ƿ������70g![]()
D.��״���£�����HCl���壬����ˮ��������Һ���ʵ���Ũ��Ϊ![]()
���𰸡�B
��������
A����NaCl�����ʵ���Ũ��Ϊx������Һǡ������10mL��![]() ��
��![]() ��Һ��ȫ��Ӧ����
��Һ��ȫ��Ӧ����![]() ��
��![]() �������ƿ���ݻ�ΪV����
�������ƿ���ݻ�ΪV����![]() �����
�����![]() ����A����
����A����
B�������£�56Lˮ������Ϊ![]() ��������ƿ����������
��������ƿ����������![]() ����B��ȷ��
����B��ȷ��
C����Ϊ����£�����ɵ��ݻ�Ϊ56L���ʿ���ʢ��������ʵ���n=![]() =2.5mol��m=nM=2.5mol��28g/mol=70g��.���ڳ��������Ħ���������
=2.5mol��m=nM=2.5mol��28g/mol=70g��.���ڳ��������Ħ���������![]() ��������ƿ���ɵĵ�������С��70g����C����
��������ƿ���ɵĵ�������С��70g����C����
D������³���HCl���壬![]() ������ˮ��������Һ���ʵ���Ũ��
������ˮ��������Һ���ʵ���Ũ��![]() ����D����
����D����
��ѡB��


 Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д�
Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д� �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ������60%��þ�ǴӺ�ˮ����ȡ�ģ���Ҫ�������£�
����˵������ȷ���ǣ� ��
A. Ϊʹ��ˮ�е�MgSO4ת����Mg��OH��2���Լ��ٿ�ѡ��ʯ����
B. �����Լ��ٺ���õ�Mg��OH��2�����ķ����ǹ���
C. �����Լ��ڷ�Ӧ�����ӷ���ʽΪ��OH��+H+=H2O
D. ͨ��������ڵ���ˮMgCl2�õ�48gMg����ת��4mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��150��ʱ����1L�������9L�������û���ܱ������ڳ��ȼ�գ����ָ���150�棬����㶨ʱ��������ѹǿ����8%����û�����������
A.������������������1��4B.��Ȳ����Ȳ���������1��4
C.��ϩ�붡����������1��4D.��ϩ�붡ϩ���������1��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ж�����Ԫ�ص�����(��֪Be��ԭ�Ӱ뾶Ϊ0.089nm)��
�� | �� | �� | �� | �� | �� | �� | �� | |
ԭ�Ӱ뾶(nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
��������ϼ� | ��2 | ��1 | ��5 | ��7 | ��1 | ��5 | ��3 | |
������ϼ� | ��2 | ��3 | ��1 | ��3 |
��1�����Ԫ�������ڱ��е�λ����____������Ԫ�ش���ͬһ�������____��(��Ԫ�ط��ű�ʾ)
��2span>��Ԫ�آٺ͢����γ����ֻ����д�����н��ȶ��Ļ�������ˮ��Ӧ�����ӷ���ʽ��____��
��3����﮲���������й㷺Ӧ�ã�����ִ������(Li2NH��)����Яʽ��Դ����(LiCoO2��)����������Ҫ��ش����⣺
��![]() Li��
Li��![]() Li���˷�Ӧ����������壬
Li���˷�Ӧ����������壬![]() LiH��
LiH��![]() LiD�������¶Ѽ��ټ�������˵����ȷ����____��
LiD�������¶Ѽ��ټ�������˵����ȷ����____��
A.![]() Li��
Li��![]() Li��Ϊͬλ�� B.
Li��Ϊͬλ�� B.![]() Li��
Li��![]() Li����ͬ�ֺ���
Li����ͬ�ֺ���
C.![]() LiH��
LiH��![]() LiD�Ļ�ѧ���ʲ�ͬ D.
LiD�Ļ�ѧ���ʲ�ͬ D.![]() LiH��
LiH��![]() LiD��ͬ������
LiD��ͬ������
������˵������ȷ����____��
A.���ԣ�Be(OH)2<LiOH<NaOH<KOH
B.�뾶��K>Na>Li>Li+
C.�����ԣ�Li+<Na+<K+<Rb+<Cs+
D.�����ԣ�Cs>Rb>K>Na>Li>Be
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NaN3)��һ�ְ�ɫ�綾���壬��������ȫ���ҵ���Ҫ�ɷ֡�NaN3������ˮ�������Ҵ���ˮ��Һ�������ԣ������ᷢ����Ӧ�������б�ը�Ե��ж�����������⡣ʵ���ҿ������������嶡��(t��BuNO2����t��Bu��ʾ�嶡��)��N2H4������������Һ��Ϸ�Ӧ�Ʊ��������ơ�
(1)�Ʊ��������嶡��
ȡһ��NaNO2��Һ��50%�����ϣ�������ӦH2SO4��2NaNO2===2HNO2��Na2SO4�����������������嶡��(t��BuOH)��40 �������Ʊ��������嶡������д���÷�Ӧ�Ļ�ѧ����ʽ��________________��
(2)�Ʊ���������(NaN3)
����ͼ��ʾ��װ����(����װ����)���з�Ӧ����Ӧ����ʽΪ��t��BuNO2��NaOH��N2H4===NaN3��2H2O��t��BuOH��

��װ��a��������________________��
�ڸ÷�Ӧ������¶���65 �棬���õ�ʵ���ʩ��____________________��
�۷�Ӧ����Һ��0 ������ȴ���д���������������ˣ����þ���ʹ����ˮ�Ҵ�ϴ�ӡ��Խ��͵����¹��˺�ʹ����ˮ�Ҵ�ϴ�Ӿ����ԭ����______________________________________________��
(3)���ʼ���
�ٳ�ȡ2.0 g�����������������100 mL��Һ������ȡ10.00 mL��Һ����ƿ�С�
���õζ��ܼ���0.10 mol��L��1���������[(NH4)2Ce(NO3)6]��Һ40.00 mL[�����ķ�ӦΪ2(NH4)2Ce(NO3)6��2NaN3===4NH4NO3��2Ce(NO3)3��2NaNO3��3N2��](�������ʾ������뷴Ӧ)��
�۳�ַ�Ӧ����Һϡ�Ͳ��ữ������2���ڷ�����ָʾҺ������0.10 mol��L��1���������[(NH4)2Fe(SO4)2]Ϊ��Һ���ζ�������Ce4�����յ�ʱ���ı���Һ20.00 mL(�ζ�ԭ����Ce4����Fe2��===Ce3����Fe3��)�������֪�������Ƶ���������Ϊ__________(����2λ��Ч����)����������������������ȷ���ζ����յ�����в����ᵼ�����ⶨ��Ʒ�е���������������ƫ�����______(����ĸ����)��
A����ƿʹ�õ���������Һ��ϴ
B���μ������������Һʱ���μ�ǰ���Ӷ������μӺ��Ӷ���
C���μ���������隣���Һʱ����ʼʱ���촦�����ݣ�����ʱ��������
D���ζ������У���������ƿ���ϵ���������隣�Һ��������ˮ���ƿ��
(4)���������ж�������ʹ�ô���������Һ�Ժ��е������Ƶ���Һ�������٣���Ӧ����Һ����������ǿ���Ҳ�����ɫ��ζ�������壬��д����Ӧ�����ӷ���ʽ��____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1 mol��L��1 NaOH��Һ�ζ�40 mL 0.1 mol��L��1 H2SO3��Һ�����õζ�������ͼ��ʾ�����Ի��ʱ��Һ����ı仯������������������ǣ� ��
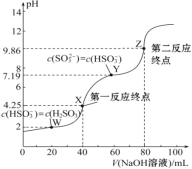
A. Ka2(H2SO3)��������Ϊ10��8
B. ���ζ�����һ��Ӧ�յ㣬���ü�����ָʾ��
C. ͼ��Z���Ӧ����Һ�У�c(Na��)>c(SO32��)>c(HSO3��)>c(OH��)
D. ͼ��Y���Ӧ����Һ�У�3c(SO32��)��c(Na��)��c(H��)��c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼA��B��C��ij����С����Ƶ���ȡ������������Ȫʵ�������װ��ʾ��ͼ����ȡNH3ѡ���Լ���ͼ��ʾ���ش��������⣺
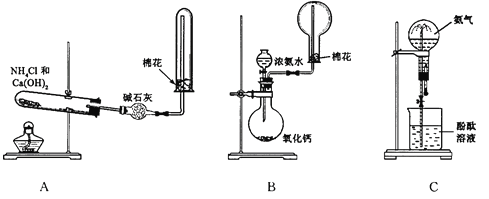
��1����Aͼ��ʾ��װ�ÿ��Ʊ������NH3
�ٷ�Ӧ�Ļ�ѧ����ʽΪ��____________________________��װ�����ռ�NH3���Թܿڷ������ŵ�������_________________________________________��
�ڸ�����и�����ܷ������ˮCaCl2___________��������_______________________��
��2����Bͼ��ʾ��װ�ÿɿ�����ȡ�ϴ���NH3������Ȫʵ�顣����Bͼ��ʾ��װ�ü��Լ��ش��������⣺
���û�ѧ����ʽ��ʾŨ��ˮ����CaO���д���NH3�ݳ��Ĺ��̣�_________________________
�ڼ���NH3�Ƿ��ռ�����ʵ�鷽���ǣ�______________________________________________��
��3����Cͼ��ʾ��װ�ý�����Ȫʵ�飬�ϲ���ƿ�ѳ������ﰱ����������Ȫ�IJ�����_______________________���÷�Ӧ��ԭ����_____________________��
��4������ȼ����һ�㲻����Ԫ�أ���β��ȴ������NO��������ԭ���û�ѧ����ʽ��ʾ_________��������������װ�д�ת�����ɼ���β���Ի�������Ⱦ������β���е��к�����CO��NO��Ӧ��ת��Ϊ�������ŷţ�д����ط�Ӧ�Ļ�ѧ����ʽ��___________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǵ�Ԫ�صļ��ּ�̬���������Ķ�Ӧ��ϵ����ش��������⣺
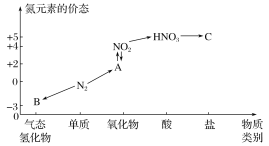
��1��д��N2��������;��_________��____��������������Ļ�������________(����)���������ڿ�������HCl�����а���������������Ļ�ѧ��Ӧ����ʽ��_________��
��2��HNO3��ͼ�е�����C�����ڼ���Cl���Ĵ��ڣ���C�Ļ�ѧʽΪ_______��
��3��NO2��ˮ��Ӧ��������A�����ӷ���ʽΪ______________��
��4��Ũ������ľ̿�ڼ��������·�Ӧ�Ļ�ѧ����ʽΪ___________________��
��5����ˮ�Լ��ԣ�д����ˮ�ĵ��뷽��ʽ______________________________��
��6��������������NO�ǹ�ҵ������ķ�Ӧ֮һ��д���÷�Ӧ�Ļ�ѧ����ʽ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W����ͼ��ʾ��ת����ϵ����X��W���ܵ������
![]()
![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]()
A.����B.����C.����D.����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com