
【题目】决定化学反应速率的主要因素是( )
A.参加反应的物质本身的性质
B.催化剂
C.温度、压强以及反应物的接触面
D.反应物的浓度
科目:高中化学 来源: 题型:
【题目】下列实验装置正确且能达到实验目的的是
A | B | C | D | |
实验目的 | 比较盐酸、碳酸、硅酸的酸性强弱 | 检验碳与浓H2SO4反应的产物中含CO2 | 验证铁的析氢腐蚀 | 模拟电解精炼铜 |
实验装置 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能跟稀盐酸反应,又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3 ③Al ④Al(OH)3 ⑤MgO ⑥(NH4)2CO3
A.①②③④⑥B.②③④⑤C.①②③④D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?____________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为_________________,未成对电子数为________________。
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点___ (填“高于”或“低于”)H2S,原因是_______;H2O中O的杂化形式为_____。H2O是_____分子(填“极性”或“非极性”)。
②[Co(NH3)4(H2O)2]Cl3Co3+配位数为___。阳离子的立体构型是___________。[Co(NH3)4(H2O)2]Cl3若其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2(H2O)2] 3+的几何异构体种数有(不考虑光学异构)___________种。
(3)金属钴是由______键形成的晶体;CoO、FeO的晶体结构类型均与氯化钠的相同,Co2+和Fe2+的离子半径分别为74.5pm和78pm,则熔点CoO______FeO。
(4)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有_____个,若晶体中Co2+与O2-的最小距离为acm,则CoO的晶体密度为_______(用含NA和a的代数式表示。结果g/cm3,已知:M(Co)=59g/mol;M(O)=16g/mol,设阿佛加德罗常数为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列有关判断不正确的是 ( )

A. 该温度下,Ksp(MnS)大于1.0×10-35
B. 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀
C. 向c(Fe2+)=0.1mol·L-1的溶液中加入CuS粉末,有FeS沉淀析出
D. 该温度下,溶解度:CuS>MnS>FeS>ZnS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_______________________ (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2溶液中的c(![]() )________(填“等于”、“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(
)________(填“等于”、“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是__________(填写字母),导致pH随温度变化的原因是___________________________________________;
②20℃时,0.1 mol/L的NH4Al(SO4)2溶液中2c(![]() )c(
)c(![]() )3c(Al3+)=_________(填数值)。
)3c(Al3+)=_________(填数值)。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是____________;在b点,溶液中各离子浓度由大到小的排列顺序是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、S02等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知: ①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式____________________________________,该热化学方程式的平衡常数K=_________(用K1、K2、K3表示)。
(2)在体积可变的恒压(p总)密闭容器中充入1molCO2 与足量的碳,让其发生反应: C(s)+ CO2(g)![]() 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
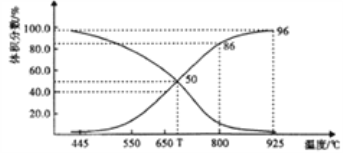
①T℃时,在容器中若充入稀有气体,v(正)___v(逆)(填“>”“<”或“="),平衡______移动(填“正向”“逆向”或“不”。下同);若充入等体积的CO2 和CO,平衡________移动。
②CO体积分数为40%时,CO2 的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡Kp常数的表达式为__________;925℃时,Kp=______(用含p总的代数式表示)。
(3)直接排放含SO2 的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。

①若是0.1mol/LNaOH 反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是______________。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色能源是指使用过程中不排放或排放极少污染物的能源,如一级能源中的水能、地热、天然气等;二级能源中电能、氢能等.下列能源属于绿色能源的是( ) ①太阳能 ②风能 ③石油 ④煤 ⑤潮汐能 ⑥木材.
A.①②③
B.③④⑤
C.④⑤⑥
D.①②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com