
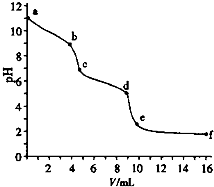
 用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如图(已知:饱和CO2溶液pH为5.6),下列说法正确的是( )
用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如图(已知:饱和CO2溶液pH为5.6),下列说法正确的是( )| A. | a处发生的离子反应:CO32-+H2O=HCO3-+OH- | |
| B. | 在pH=6时,c(Na+)>c(HCO3-)>c(CO32-) | |
| C. | 在pH=7时,c(Na+)=c(Cl-) | |
| D. | c→d发生的主要离子反应:CO32-+H+=HCO3- |
分析 A、根据滴定之前溶液的pH,盐酸的体积是零,碳酸钠溶液水解显示碱性来判断;
B、在pH=6时,溶液显酸性,根据溶液的组成情况确定离子浓度的大小关系;
C、根据电荷守恒以及溶液显示中性时氢离子和氢氧根离子浓度相等来判断;
D、根据pH变化图象结合滴定实际来回答.
解答 解:A、滴定之前碳酸钠溶液的pH=11,所以溶液中氢氧根离子的浓度为0.001 mol•L-1,该Na2CO3溶液中碳酸根离子水解导致溶液显示碱性,发生反应为:CO32-+H2O?HCO3-+OH-,水解程度很弱,应该使用可逆号,故A错误;
B、在pH=6时,溶液显酸性,溶液的组成可能是:碳酸氢钠和饱和二氧化碳溶液的混合物,此时c(Na+)>c(HCO3-)>c(CO32-),故B正确;
C、在pH=7时,溶液显示中性,氢离子和氢氧根离子浓度相等,此时溶液中还含有碳酸根离子和碳酸氢根离子,所以钠离子大于氯离子浓度,故C错误;
D、根据pH变化曲线,可以看出c到d阶段,随着盐酸的加入,碳酸氢根与氢离子反应,故D错误.
故选B.
点评 本题综合考查离子浓度的大小比较,题目难度较大,本题注意分析反应物的物质的量之间的关系,判断反应的程度以及溶液的主要成分是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NO2为酸性氧化物 | |
| B. | H2O很稳定是因为水分子之间存在氢键 | |
| C. | 反应③中每生成22.4 LN2,转移电子数1.5NA | |
| D. | NH3的沸点比PH3的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀的pH | 3.2 | 9.0 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL0.10mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) | |
| C. | 在NaHCO3溶液中加入等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- | |
| D. | 中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| D | 常温下白磷可自燃而N2须在放电时才与O2反应 | 非金属性:P>N |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯原子的原子结构示意图: | |
| B. | C2H4的结构简式:CH2CH2 | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | CH4 分子的结构模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与石灰乳反应制漂白粉 | B. | 钠在氯气中燃烧生成氯化钠 | ||
| C. | 氯化铵与氢氧化钙共热制氨气 | D. | 浓盐酸与二氧化锰共热制氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com