
某二元酸(化学式H2A)在水中的电离方程式是H2A→ H+ + HA-、HA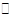 H++A2-又知0.1 mol/L NaHA溶液的pH = 2。则下列说法不正确的是…………………(
)
H++A2-又知0.1 mol/L NaHA溶液的pH = 2。则下列说法不正确的是…………………(
)
A、因为A2-+H2O 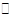 HA-+OH-,所以Na2A溶液显碱性
HA-+OH-,所以Na2A溶液显碱性
B、0.1 mol/L H2A溶液中氢离子的物质的量浓度为0.11 mol/L
C、NaHA溶液中各种离子浓度的关系是c(Na+ ) > c(HA-) > c(H+) > c(A2-) > c(OH- )
D、在NaHA溶液中,HA-电离的趋势大于其水解的趋势
科目:高中化学 来源:北京市东城区2004—2005学年度第一学期期末教学目标检测、高三化学 题型:022
| |||||||||||||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com