
| A.该粒子不显电性 | B.该粒子质量数为4 |
| C.在周期表中与氢元素占同一位置 | D.该粒子质量比氢原子大 |
科目:高中化学 来源:不详 题型:填空题
| 元素 | 部分结构知识 | 部分性质 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素的性质或原子结构 |
| X | 最外层电子数是次外层电子数的3倍 |
| Y | 常温下单质是双原子分子,其氢化物的水溶液显碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铅位于周期表中金属与非金属元素交界处,可做半导体材料 |
| B.若存在简单阴离子R2-,则R一定属于第ⅥA族元素 |
| C.S和Se属于第ⅥA族元素,H2S还原性比H2Se的强 |
| D.元素原子最外层电子数较少的金属一定比最外层电子数较多的金属活动性强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.质子数相同的微粒之间一定互称同位素 |
| B.I A族与ⅦA族元素间形成的化合物一定是离子化合物 |
| C.同主族元素的简单阴离子半径越大,其单质氧化性越弱 |
| D.同周期金属元素的化合价越高,其氢氧化物的碱性越强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同周期元素的原子半径以VIIA族的为最大 |
| B.同主族元素两种元素原子的核外电子数的差值可能为26 |
| C.短周期元素中次外层电子数是最外层电子数2倍的原子一定是非金属元素 |
| D.科学家在周期表中金属与非金属的分界线处找到了优良的催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②⑤ | B.①③⑤ | C.②③④ | D.①⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
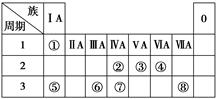
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com