
(1) 在一定温度下,测得0.1 mol·L-1CH3COOH溶液的PH为3.0。则CH3COOH在水中的电离为 ,此温度CH3COOH的电离平衡常数为 。
(2) 在25℃时,Kw=1.0×10-14,测得0.1 mol·L-1 Na2A溶液的pH=7。则H2A在水溶液中的电离方程式为 ,该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH= 。
(3) 已知HCN(aq)+NaOH(aq)=NaCN(aq)+ H2O(l) ΔH=-12.1 kJ·mol-1;
HCl(aq) +NaOH(aq)=NaCl(aq) + H2O(l) ΔH=-57.3 kJ·mol-1。
则在水溶液中HCN H++CN-电离的ΔH为
kJ·mol-1
H++CN-电离的ΔH为
kJ·mol-1
(1) 1% 10-5 (2) H2A=2H++A2- 3 (3) +45.2
【解析】
试题分析:(1)CH3COOH CH3COO-+H+。PH=3.0,C(H+)=10-3mol/LC(CH3COOH)=0.1mol/L所以CH3COOH在水中的电离度为10-3mol/L÷0.1mol/L×100%=1%.在此温度下CH3COOH的电离平衡常数为(10-3mol/L)2/0.1mol/L=10-5mol/L.(2) 在25℃时,Kw=1.0×10-14,测得0.1 mol·L-1
Na2A溶液的pH=7,说明H2A是强酸。所以H2A在水溶液中的电离方程式H2A=2H++A2-。将0.01
mol·L-1 H2A溶液稀释到20倍后,则C(H+)=(2×0.01mol/L)÷20=0.001mol/L,所以溶液的pH=3。(3)若HCN为强酸,则它与NaOH反应产生1mol的水放出热量也是57.3 kJ·mol-1。现在放出热量12.1 kJ·mol-1,比强酸与氢氧化钠反应放出的热量少45.2KJ/mol.,说明在水溶液中HCN电离吸收热量为45.2KJ/mol.所以HCN
CH3COO-+H+。PH=3.0,C(H+)=10-3mol/LC(CH3COOH)=0.1mol/L所以CH3COOH在水中的电离度为10-3mol/L÷0.1mol/L×100%=1%.在此温度下CH3COOH的电离平衡常数为(10-3mol/L)2/0.1mol/L=10-5mol/L.(2) 在25℃时,Kw=1.0×10-14,测得0.1 mol·L-1
Na2A溶液的pH=7,说明H2A是强酸。所以H2A在水溶液中的电离方程式H2A=2H++A2-。将0.01
mol·L-1 H2A溶液稀释到20倍后,则C(H+)=(2×0.01mol/L)÷20=0.001mol/L,所以溶液的pH=3。(3)若HCN为强酸,则它与NaOH反应产生1mol的水放出热量也是57.3 kJ·mol-1。现在放出热量12.1 kJ·mol-1,比强酸与氢氧化钠反应放出的热量少45.2KJ/mol.,说明在水溶液中HCN电离吸收热量为45.2KJ/mol.所以HCN H++CN-电离的ΔH为+45.2kJ·mol-1。
H++CN-电离的ΔH为+45.2kJ·mol-1。
考点:考查弱电解质的电离度、电离平衡常数及溶液稀释问题的知识。


 能力评价系列答案
能力评价系列答案科目:高中化学 来源: 题型:
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
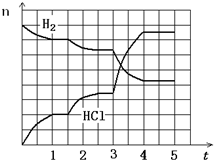 (2013?河东区一模)工业上高纯硅可以通过下列反应制取:
(2013?河东区一模)工业上高纯硅可以通过下列反应制取:| 高温 |
| c4(HCl) |
| c(SiCl4)?c2(H2) |
| c4(HCl) |
| c(SiCl4)?c2(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| c12(HCl) |
| c3(SiCl4)c2(N2)c6(H2) |
| c12(HCl) |
| c3(SiCl4)c2(N2)c6(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| [CO2]3 |
| [CO]3 |
| [CO2]3 |
| [CO]3 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c3(CO) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com