
【题目】磷在氧气中燃烧,可能生成两种固态氧化物.3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出XKJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是________。
(2)已知单质磷的燃烧热为Y KJ/mol,则1mol P与O2反应生成固态P2O3的热化学反应方程式:________。
【答案】P2O3、P2O5P(s)+![]() O2(g)=
O2(g)=![]() P2O3(s)△H=﹣(20X﹣Y)kJ/mol
P2O3(s)△H=﹣(20X﹣Y)kJ/mol
【解析】
(1)根据氧化还原反应中得失电子数相等判断其产物;(2)先写出磷的燃烧热化学反应方程式和.1g的单质磷(P)在3.2g的氧气中燃烧的热化学反应方程式,将方程式进行整理得出磷燃烧生成三氧化二磷的热化学反应方程式,其焓变相应改变。
(1)磷在氧气中燃烧是氧化还原反应,3.2g氧气参加反应得到电子的物质的量=![]() =0.4mol;假设生成的固体是三氧化二磷,磷失去电子的物质的量=
=0.4mol;假设生成的固体是三氧化二磷,磷失去电子的物质的量=![]() ×3=0.3mol,得失电子数不相等,所以该固体不是纯净的三氧化二磷;假设生成的固体是五氧化二磷,磷失去电子的物质的量=
×3=0.3mol,得失电子数不相等,所以该固体不是纯净的三氧化二磷;假设生成的固体是五氧化二磷,磷失去电子的物质的量=![]() ×5=0.5mol,得失电子数不相等,所以该固体不是纯净的三氧化二磷;失去的电子数应该在二者之间,所以生成的固体是两种固体的混合物,即P2O3、P2O5,故答案为:P2O3、P2O5;(2)磷燃烧的热化学方程式为:P(s)+
×5=0.5mol,得失电子数不相等,所以该固体不是纯净的三氧化二磷;失去的电子数应该在二者之间,所以生成的固体是两种固体的混合物,即P2O3、P2O5,故答案为:P2O3、P2O5;(2)磷燃烧的热化学方程式为:P(s)+![]() O2(g)=
O2(g)=![]() P2O5 (s)△H=﹣Y kJ/mol①,3.1g的单质磷(P)在3.2g的氧气中燃烧生成三氧化二磷和五氧化二磷的热化学反应方程式为:4P(s)+4O2(g)=P2O5(s)+P2O3(s)△H=﹣40X KJ/mol②,将方程式
P2O5 (s)△H=﹣Y kJ/mol①,3.1g的单质磷(P)在3.2g的氧气中燃烧生成三氧化二磷和五氧化二磷的热化学反应方程式为:4P(s)+4O2(g)=P2O5(s)+P2O3(s)△H=﹣40X KJ/mol②,将方程式![]() 得P(s)+
得P(s)+![]() O2(g)=
O2(g)=![]() P2O3(s)△H=﹣(20X﹣Y)KJ/mol,故答案为:P(s)+
P2O3(s)△H=﹣(20X﹣Y)KJ/mol,故答案为:P(s)+![]() O2(g)=
O2(g)=![]() P2O3(s)△H=﹣(20X﹣Y)kJ/mol。
P2O3(s)△H=﹣(20X﹣Y)kJ/mol。


科目:高中化学 来源: 题型:
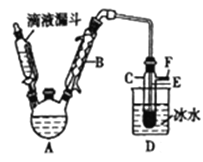
【题目】下图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置。有关数据见下表。
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)制备操作中,加入的浓硫酸必须进行稀释,其目的是_____(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(2)己知加热温度较低时NaBr与硫酸反应生成NaHSO4,写出加热时A中发生的主要反应的化学方程式:________________。
(3)仪器B的名称是________,冷却水应从B的____(填“上“或“下")口流进。
(4)反应生成的溴乙烷应在______(填“A"或"C")中。
(5)若用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,最好选择下列_____(填字母)溶液来洗涤产品。
a氢氧化钠 b.碘化亚铁 c.亚硫酸钠 d.碳酸氢钠
洗涤产品时所需要的玻璃仪器有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究一氧化氮、二氧化氮、硝酸之间的相互转化,有同学设计了如下实验:如图将少量铜片装入小试管中,再加人适量稀硝酸,然后迅速将大试管倒扣在小试管外。将套好的大、小试管一起竖立在烧杯中,使水浸没大试管口。充分反应完后,通过弯玻璃管往大试管中吹人足量空气,并往烧杯中滴人几滴紫色石蕊试液。试回答:
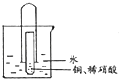
(1)写出铜片溶于稀硝酸的离子方程式________。
(2)吹入空气前小试管中的现象是铜片逐渐溶解.溶液变蓝色及________。
(3)假设小试管中加入了 0.192g铜片和5ml浓度为2mol/L的稀硝酸,则充分反应后小试管内溶 液中NO ![]() 物质的量浓度为________mol/L(忽略溶液体积变化)。
物质的量浓度为________mol/L(忽略溶液体积变化)。
(4)若将水换成氢氧化钠溶液,实验过程中生成的一种红棕色气体会与它发生反应,生成两种钠盐和水,且氧化产物与还原产物的物质的量相等,试写出该反应的离子方程式________。
(5)将等质里的铜片分别与等体积过量的浓、稀硝酸反应(假设溶液体积不变 所得溶液前者呈绿色,后者呈蓝色。某同学认为可能是Cu2+浓度的差异引起的,你认为是否正确?________(填“正确”或“不正确”),理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 用托盘天平直接称量烧碱4.0g
B. 在蒸发皿中灼烧CuSO4·5H2O晶体以除去结晶水
C. 用标准盐酸溶液滴定未知浓度的氨水,用酚酞作指示剂
D. 配制0.9%的氯化钠溶液时,将称量的氯化钠放入烧杯中加计量的水搅拌溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等。实验室制备二茂铁装置示意图如右下图(二茂铁熔点是173℃,在100℃时开始升华;沸点是249℃)。实验步骤为:
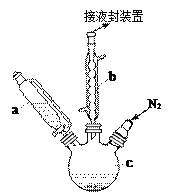

①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a中加入60mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10min;
②再从仪器a滴入5.5mL新蒸馏的环戊二烯(密度0.95g/cm3),搅拌;
③将6.5g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25ml装入仪器a中,慢慢滴入仪器c中,45min滴完,继续搅拌45min;
④再从仪器a加入25mL无水乙醚搅拌;
⑤将c中的液体转入仪器d,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器b的名称是_________,作用是_________________________。
(2)步骤①中通入氮气的目的是________________________________。
(3)仪器c的适宜容积应为______:①100ml、②250ml、③500ml;仪器a使用前应进行的操作是_____,其操作过程为:关闭恒压滴液漏斗颈部旋塞_______________________。
(4)KOH、FeCl2、C5H6反应生成二茂铁[Fe(C5H5)2]和KCl的化学方程式为________________________________;步骤⑦是二茂铁粗产品的提纯,该过程在右图中进行,其操作名称为__________。
(5)为了确证得到的是二茂铁,还需要进行的一项简单实验是_____。
(6)最终得到纯净的二茂铁3.7g,则该实验的产率为_______(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g)![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/mol·L-1 | c(I2)/mol·L-1 | c(HI)/mol·L-1 | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | —— |
下列判断正确的是
A. H2的平衡浓度:a=b>0.004 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率等于20% D. 丙中条件下,该反应的平衡常数K=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由 Al、CuO、Fe2O3 组成的混合物共 10.0g,放入 500mL 某浓度盐酸溶液中,混合物完全溶解,当再 加入 250mL 2.0mol/L 的 NaOH 溶液时,得到的沉淀最多。该盐酸的浓度为( )
A. 0.5 mol/L B. 3.0 mol/L C. 1.0 mol/L D. 2.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是( )
A.胶体粒子直径在1~100nm之间B.胶体粒子带正电荷
C.胶体粒子不能穿过半透膜D.胶体粒子能够发生聚沉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com