
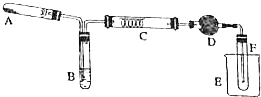
 ij��ѧ��ȤС���ʵ�����Ҵ�������ʵ��װ�ý����˸Ľ�����ͼ���Թ�A��Ϊ������ع��壬�Թ�B��Ϊ��ˮ�Ҵ���Ӳ���Թ�C��Ϊ�Ƴ�����״��ϸ��˿�������D��Ϊ��ˮ����ͭ��ĩ����ͼ�м����������г�װ�õȶ�����ȥ��
ij��ѧ��ȤС���ʵ�����Ҵ�������ʵ��װ�ý����˸Ľ�����ͼ���Թ�A��Ϊ������ع��壬�Թ�B��Ϊ��ˮ�Ҵ���Ӳ���Թ�C��Ϊ�Ƴ�����״��ϸ��˿�������D��Ϊ��ˮ����ͭ��ĩ����ͼ�м����������г�װ�õȶ�����ȥ������ ��1������ʵ�����̺ͷ�Ӧԭ������A�Ǽ�����������B��Ҫ�õ��Ҵ�������Ҫ���ȣ��Ҵ��Ĵ�������Ҫ���ȣ�
��2��ˮԡ���ȿ���ʹB���Ҵ�ƽ����������������C���Ҵ�������Ϊ��ȩ��ˮ��
��3���Ҵ�������Ϊ��ȩ��ˮ������ͭ���ڱ�죬��ɫ��ĩ��ˮ����ͭ��ˮ����ɫ��
��4����ȩ�е�Ϊ20.8�棬���Խ����¶ȿ�������ȩ��Һ����ڣ�
��5��E�е��Թ��������ȩ��Ӧ�ü�һ��С�̵��ܣ���֤��ѹ��ͨ��
��� �⣺��1��װ���з�Ӧ��������Ҫ�Ʊ��������Ҵ������ڼ���ʱ��Ӧ������ȩ��������Ҫ���ȵ�װ���У�A�Ǽ�����������B��Ҫ�õ��Ҵ�������Ҫ���ȣ�C���Ҵ��Ĵ�������Ҫ���ȣ���ѡABC��
��2��ˮԡ���ȿ���ʹB���Ҵ�ƽ����������������C���Ҵ�������Ϊ��ȩ��ˮ����2CH3CH2OH+O2$��_{��}^{Cu}$2CH3CHO+2H2O���ʴ�Ϊ������ˮԡ���ȣ�2CH3CH2OH+O2$��_{��}^{Cu}$2CH3CHO+2H2O��
��3���Ҵ�������Ϊ��ȩ��ˮ������ͭ���DZ�����Ϊ����ͭ��Ȼ������ͭ����ԭΪ����ͭ������ͭ�Ǵ�����������ͭ����ɫ�仯�����ڱ�죬C���������Ǻ��ڱ��
���Ҵ�������Ϊ��ȩ��ˮ��D����˿ɹ۲쵽��ɫ��ĩ��ˮ����ͭ��ˮ����ɫ���ʴ�Ϊ�����ڱ�죻��ɫ��ĩ��ˮ����ͭ����ɫ��
��4����ȩ�е�Ϊ20.8�棬���Խ����¶ȿ�������ȩ��Һ����ڣ�ʢ�ŵ��DZ�ˮ����
��5��E�е��Թܴ��е����Թ�������ѹ����ͨ���������ȩ��Ӧ�ü�һ��С�̵��ܣ���֤��ѹ��ͨ��
�ʴ�Ϊ��E�е��Թܴ��е����Թ�������Ϊ˫���Թ�����������С���ܣ�
���� ���⿼�����������ʵ�ʵ����֤��ʵ�鷽����Ʒ�����ʵ�������жϣ���Ӧԭ����Ӧ�ã������������ʺ�ʵ����������ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д� ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ƵĽ����������ͭǰ�棬���Խ����ƿ����û�������ͭ��Һ�е�ͭ | |
| B�� | ��������ʢ�ź�����Ũ���� | |
| C�� | ��������ˮ�γɵ�Al��OH��3����������ˮ�������������ˮ�ľ��� | |
| D�� | ��������Ʒ���渲��������Ĥ�����ڲ������𱣻����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
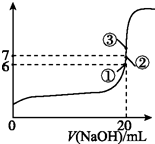 ����ƽ�ⳣ������Ka��ʾ���Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��
����ƽ�ⳣ������Ka��ʾ���Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��| ��ѧʽ | HF | H2CO3 | HClO |
| ����ƽ�ⳣ����Ka�� | ��7.2��10-4 | K1=4.4��10-7 K2=4.7��10-11 | ��3.0��10-8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
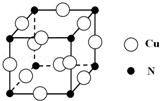 ��͵�Ԫ���ڻ�ѧ���к���Ҫ�ĵ�λ���ش��������⣺
��͵�Ԫ���ڻ�ѧ���к���Ҫ�ĵ�λ���ش��������⣺ ��Ԥ����2017�귢��ġ��϶���š�̽�������õij���5�����ػ��ȼ��Ϊƫ������[��CH3��2NNH2]����CH3��2NNH2��Nԭ�ӵ��ӻ���ʽΪsp3��
��Ԥ����2017�귢��ġ��϶���š�̽�������õij���5�����ػ��ȼ��Ϊƫ������[��CH3��2NNH2]����CH3��2NNH2��Nԭ�ӵ��ӻ���ʽΪsp3��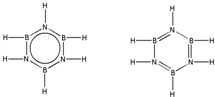 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu+4HNO3�TCu��NO3��2+2NO2��+2H2O | B�� | 2NaOH+CuSO4�TNa2SO4+Cu��OH��2�� | ||
| C�� | 2CO+O2�T2CO2 | D�� | 2Al+2NaOH+2H2O�T2NaAlO2+3H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
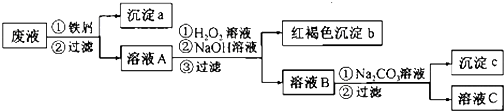
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
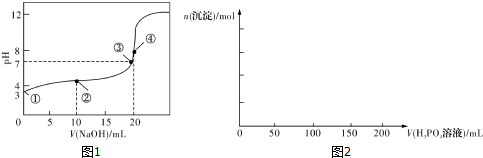
| n��SO32-����n��HSO3-�� | 1��9 | 1��1 | 1��91 |
| pH | 8.2 | 7.2 | 6.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һ�������£���1 mol N2��3 mol H2��ϣ���ַ�Ӧ��ת�Ƶĵ�����Ϊ6 NA | |
| B�� | 1.5 mol NO2������ˮ��Ӧ��ת�Ƶĵ�����Ϊ1.5 NA | |
| C�� | 6.4 g��S2��S4��S8��ɵĻ���ﺬ��ԭ����Ϊ0.2 NA | |
| D�� | ���³�ѹ�£�11.2 L Cl2����ԭ����ΪNA |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com