
| A、无色NO气体遇空气变为红棕色 | B、紫色石蕊试液滴入盐酸中,溶液变红 | C、往酸性KMnO4溶液中通入乙烯,溶液褪色 | D、往红墨水中投入活性碳,红色褪去 |


科目:高中化学 来源:2013届新疆乌鲁木齐地区高三第一次诊断性测验化学试卷(带解析) 题型:填空题
氧化还原滴定与酸碱中和滴定一样是化学实验室常用的定量测定方法。某氧化还 原滴定的反应体系中有反应物和生成物共六种,
 ,其中H2SO3的还原性最强,KMnO4的氧化性最强。对此反应体系:
,其中H2SO3的还原性最强,KMnO4的氧化性最强。对此反应体系:
(1) 被氧化的元素是_______;发生还原反应的过程是________→______。
(2) 请用这六种物质组织一个合理的化学反应,写出它的离子方程式:_______
(3) 反应中H2SO4是_______ (填编号)
A,氧化剂 B.氧化产物 C.生成物 D.反应物
(4) 当有20mL 0.1mol/L的氧化剂参加反应时,电子转移数目是_______ 。
(5) 用标准KMnO4溶液滴定H2SO3时,滴定终点时颜色变化是_______。
(6) 滴定过程中.下列图像所表示的关系正确的是_______(填编号)。
查看答案和解析>>
科目:高中化学 来源:2014届江西省高三上学期第二次月考化学试卷(解析版) 题型:填空题
某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子.该厂拟定如图所示的废水处理流程。
 回答以下问题:
回答以下问题:
(1)步骤②发生反应的离子方程式可表示如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述离子方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为 (填选项标号)。
A.1 B.1/2 C.2 D.不能确定
②若d=e=1,则b= 。
③若反应中转移0.6mol电子,则生成的气体在标况下的体积是 。
(2)步骤③中反应时,每0.4molCr2O72-转移2.4mol的电子,该反应的离子方程式为 。
(3)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少. 请用离子方程式表示出现上述颜色变化的原因。
①产生蓝色沉淀的离子方程式为 ,②后又变黑色沉淀的离子方程式为 。
(4)铜是与人类关系非常密切的有色金属,已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生;2Cu+= Cu+ Cu2+。大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等。
①写出CuH在过量稀盐酸中有气体生成的离子方程式 。
②将CuH溶解在适量的稀硝酸中,完成下列反应的化学方程式:

查看答案和解析>>
科目:高中化学 来源:2012-2013学年新疆乌鲁木齐地区高三第一次诊断性测验化学试卷(解析版) 题型:填空题
氧化还原滴定与酸碱中和滴定一样是化学实验室常用的定量测定方法。某氧化还 原滴定的反应体系中有反应物和生成物共六种,
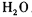 ,其中H2SO3的还原性最强,KMnO4的氧化性最强。对此反应体系:
,其中H2SO3的还原性最强,KMnO4的氧化性最强。对此反应体系:
(1) 被氧化的元素是_______;发生还原反应的过程是________→______。
(2) 请用这六种物质组织一个合理的化学反应,写出它的离子方程式:_______
(3) 反应中H2SO4是_______ (填编号)
A,氧化剂 B.氧化产物 C.生成物 D.反应物
(4) 当有20mL 0.1mol/L的氧化剂参加反应时,电子转移数目是_______ 。
(5) 用标准KMnO4溶液滴定H2SO3时,滴定终点时颜色变化是_______。
(6) 滴定过程中.下列图像所表示的关系正确的是_______(填编号)。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:
交通警察使用的“司机酒后驾车检测器”是应用氧化还原反应原理制成的,其反应的化学方程式为(Cr为铬元素):4CrO3 + C2H5OH + 6H2SO4 = 2Cr2(SO4)3 + 2CO2↑ + 9H2O
CrO3是一种红色固体,它在酸性条件下与酒精蒸气反应生成蓝绿色的硫酸铬,根据颜色变化来判断司机是否饮酒。下列说法不正确的是
A.CrO3是氧化剂
B.酒精是还原剂
C.当2mol CrO3被还原时,有3mol电子发生转移
D.当0.02mol酒精参与反应时,生成的CO2在标准状况下的体积为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com