
用NA表示阿伏加德罗常数的值,下列叙述中不正确的是 ( )
①12.4g白磷晶体中含有的P-P键数约是0.6 NA
②电解精炼铜时转移了NA个电子,阳极溶解32 g铜
③7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA
④2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质
分子数大于2 NA
⑤2.9g 2CaSO4·H2O含有的结晶水分子数为0.02 NA (2CaSO4·H2O式量为290)
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA
A.①②③④⑤⑦ B.②③⑤⑥ C.①③④⑤⑥ D.③④⑤⑥⑦
科目:高中化学 来源: 题型:
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。回答下列问题:
①在同一溶液中,H2CO3、HCO3-、 CO32-(填:“能”或“不能”) 大量共存。
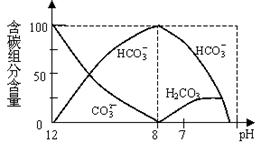 ②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是: 。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是: 。
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh

 2×10-4,当溶液中c(HCO3-)︰c(CO32-)
2×10-4,当溶液中c(HCO3-)︰c(CO32-) 2︰1时,溶液的pH
2︰1时,溶液的pH 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
|
 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | ||||
| 二 | ① | ② | ③ | ④ | ||||||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是_______。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______ (填元素符号),判断的实验依据是________________________________________________ (写出一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中的杂质(括号内的物质)除去时,所使用的试剂和主要操作都正确的是( )
| 选项 | 物质 | 使用的试剂 | 主要操作 |
| A | 乙醇(水) | 金属钠 | 过滤 |
| B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| C | 苯(苯酚) | 浓溴水 | 振荡、分液 |
| D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 冼气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:乙醇、1,2二溴乙烷、乙醚的有关物理性质如下表所示。
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 通常状况 下的状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
| 熔点/℃ | -130 | 9 | -116 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
某化学小组拟用乙醇、溴等为原料在实验室制备少量的1,2二溴乙烷,实验装置如图所示(装置A中的加热部分的仪器装置省略没有画出)。
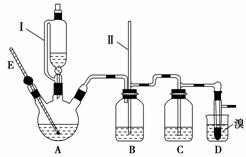
(1)仪器E的名称是_______________________________________________。
(2)仪器I是漏斗,其左部的玻璃管的作用是________(填字母)。
a.使漏斗中液体容易滴下
b.有利于吸收气体杂质
c.防止A中三颈烧瓶里的液体爆沸
(3)实验时,A中三颈烧瓶里放入几片碎瓷片的目的是__________________。
加热反应过程中,三颈烧瓶里除生成乙烯外,还可能生成的有机副产物主要是__________________________________________________________________。
(4)反应过程中,若B中长玻璃导管(II)里的液面上升,则说明可能是由于________(填“D中 出现堵塞”或“C中杂质已除尽”)造成的。
(5)反应过程中, D中需用冷水冷却盛有液溴的试管, 其主要目的是________。
说明制备1,2二溴乙烷的反应已经结束的实验现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式与所述事实相符且正确的是 ( )
A.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
B.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO—+Fe(OH)3= FeO42—+3Cl—+H2O+H+
C.向NaAlO2溶液中通入过量CO2制Al(OH)3: AlO2-+CO2+2H2O= Al(OH)3↓+HCO3-
D.向含有a mol FeBr2的溶液中,通入x mol Cl2。若x=a,则反应的离子方程式为:
2Fe2++ 2Br-+ 2Cl2=Br2 + 2Fe3++ 4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
我国海水资源丰富,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3—等离子。合理利用海水资源和保护环境是我国可持续发展的重要保证。
Ⅰ.火力发电燃煤排放的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
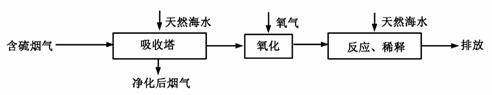
⑴天然海水的pH≈8,呈弱碱性。用离子方程式解释原因 。
⑵天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是 ;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是 。
Ⅱ.重金属离子对河流及海洋造成严重污染。某化工厂废水(pH=2.0,ρ≈1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
⑶你认为往废水中投入 (填字母序号),沉淀效果最好。
A. NaOH B. Na2S C. KI D. Ca(OH)2
⑷如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= 。
⑸如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%。若环境要求排放标准为c(Ag+)低于1.0×10-8mol·L-1,问该工厂处理后的废水中c(Ag+)= ,是否符合排放标准 (填“是”或“否”)。(已知KSP(AgCl)=1.8×10-10mol2·L-2)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
①2C(s)+O2(g)===2CO(g)
ΔH=-221.0 kJ·mol-1;
②2H2(g)+O2(g)===2H2O(g)
ΔH=-483.6 kJ·mol-1。
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为( )
A.+262.6 kJ·mol-1 B.-131.3 kJ·mol-1
C.-352.3 kJ·mol-1 D.+131.3 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com