
| 元素 | 相 关 信 息 |
| X | 基态原子核外有三个能级,每个能级的电子数都相等 |
| Y | Y与Z不在同一周期,其原子核外未成对电子数比电子层数多1 |
| Z | 可与W形成两种化合物,且水溶液均呈酸性 |
| W | 是地壳中质量百分含量第二的金属元素 |


科目:高中化学 来源: 题型:
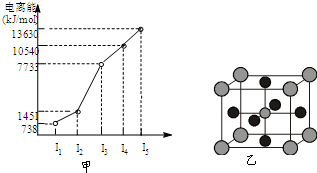 有X、Y、Z、W四种元素,原子序数依次减小.已知X是第四周期的主族元素,其部分电离能如图甲所示;X、Y元素具有相同的最高正化合价;Z 原子p轨道共有3个电子;W原子价电子排布式为nsnnpn.
有X、Y、Z、W四种元素,原子序数依次减小.已知X是第四周期的主族元素,其部分电离能如图甲所示;X、Y元素具有相同的最高正化合价;Z 原子p轨道共有3个电子;W原子价电子排布式为nsnnpn.查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)短周期主族元素X、Y、Z、W的原子序数依次增大,其中X、Y、Z位于不同周期,Y是形成化合物种类最多的元素,W2+与Ne原子具有相同的电子层结构.
(1)由X、Y组成的最简单化合物可作某一燃料电池的 极反应物.
(2)Z 与氧组成的某种化合物可作为潜水员的供氧剂,该化合物中含有的化学键是
(3)即热饭盒中,有W的单质与铁粉、固体食盐组成混合物A,使用时将水加入A中,几分钟后饭菜变热了.从能量转化角度看,该过程是化学能转化为 能,写出W与水反应的化学方程式:
(4)500℃时,密闭容器中充入1mol·L-1 CO2和3mol ·L-1 H2发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
测得有关数据如下:
500℃时该反应的平衡常数K= (保留一位小数),平衡时CO2的转化率为 ,温度升高,K值增大,则正反应为 热反应(填“吸”或“放”).
(5)已知:298K时,Ca(s) =Ca2+(g) +2e- ; △H=+ 1807kJ.mol-1
1/2O2(g)+2e-=O2- (g); △H=+986kJ.mol-l
Ca2+(g)+O2-( g)= CaO(s) ; ΔH=- 3528. 5kJ.mol-l
298K时,金属钙和氧气反应生成CaO固体的热化学方程式为:
查看答案和解析>>
科目:高中化学 来源:2010届陕西留坝中学高三模拟考试化学卷 题型:填空题
(12分)短周期主族元素X、Y、Z、W的原子序数依次增大,其中X、Y、Z位于不同周期,Y是形成化合物种类最多的元素,W2+与Ne原子具有相同的电子层结构.
(1)由X、Y组成的最简单化合物可作某一燃料电池的 极反应物.
(2)Z 与氧组成的某种化合物可作为潜水员的供氧剂,该化合物中含有的化学键是
(3)即热饭盒中,有W的单质与铁粉、固体食盐组成混合物A,使用时将水加入A中,几分钟后饭菜变热了.从能量转化角度看,该过程是化学能转化为 能,写出W与水反应的化学方程式:
(4)500℃时,密闭容器中充入1mol ·L-1 CO2和3mol ·L-1 H2发生反应:
CO2(g)+3H2(g)  CH3OH(g) +H2O(g)
CH3OH(g) +H2O(g)
测得有关数据如下:
500℃时该反应的平衡常数K=" " (保留一位小数),平衡时CO2的转化率为 ,温度升高,K值增大,则正反应为 热反应(填“吸”或“放”).
(5)已知:298K时,Ca(s) =Ca2+(g) +2e- ; △H="+" 1807kJ.mol-1
1/2O2(g)+2e-= O2- (g); △H=+986kJ.mol-l
Ca2+(g) +O2-( g)=" CaO(s)" ; ΔH="-" 3528. 5kJ.mol-l
298K时,金属钙和氧气反应生成CaO固体的热化学方程式为:
查看答案和解析>>
科目:高中化学 来源:2010届陕西留坝中学高三模拟考试化学卷 题型:填空题
(12分)短周期主族元素X、Y、Z、W的原子序数依次增大,其中X、Y、Z位于不同周期,Y是形成化合物种类最多的元素,W2+与Ne原子具有相同的电子层结构.
(1)由X、Y组成的最简单化合物可作某一燃料电池的 极反应物.
(2)Z 与氧组成的某种化合物可作为潜水员的供氧剂,该化合物中含有的化学键是
(3)即热饭盒中,有W的单质与铁粉、固体食盐组成混合物A,使用时将水加入A中,几分钟后饭菜变热了.从能量转化角度看,该过程是化学能转化为 能,写出W与水反应的化学方程式:
(4)500℃时,密闭容器中充入1mol ·L-1 CO2和3mol ·L-1 H2发生反应:
CO2(g)+3H2(g)
 CH3OH(g)
+H2O(g)
CH3OH(g)
+H2O(g)
测得有关数据如下:

500℃时该反应的平衡常数K= (保留一位小数),平衡时CO2的转化率为 ,温度升高,K值增大,则正反应为 热反应(填“吸”或“放”).
(5)已知:298K时,Ca(s) =Ca2+(g) +2e- ; △H=+ 1807kJ.mol-1
1/2O2(g)+2e-= O2- (g); △H=+986kJ.mol-l
Ca2+(g) +O2-( g)= CaO(s) ; ΔH=- 3528. 5kJ.mol-l
298K时,金属钙和氧气反应生成CaO固体的热化学方程式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W的原子序数依次增大,其中X、Y、Z位于不同周期,Y是形成化合物种类最多的元素,W2+与Ne原子具有相同的电子层结构.
(1)由X、Y组成的最简单化合物可作某一燃料电池的 极反应物.
(2)Z 与氧组成的某种化合物可作为潜水员的供氧剂,该化合物中含有的化学键是
(3)即热饭盒中,有W的单质与铁粉、固体食盐组成混合物A,使用时将水加入A中,几分钟后饭菜变热了.从能量转化角度看,该过程是化学能转化为 能,写出W与水反应的化学方程式:
(4)500℃时,密闭容器中充入1mol ·L-1 CO2和3mol ·L-1 H2发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g)
CH3OH(g) +H2O(g)
测得有关数据如下:
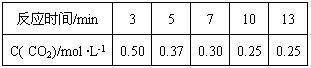
500℃时该反应的平衡常数K= (保留一位小数),平衡时CO2的转化率为 ,温度升高,K值增大,则正反应为 热反应(填“吸”或“放”).
(5)已知:298K时,Ca(s) =Ca2+(g) +2e- ; △H=+ 1807kJ.mol-1
1/2O2(g)+2e-= O2- (g); △H=+986kJ.mol-l
Ca2+(g) +O2-( g)= CaO(s) ; ΔH=- 3528. 5kJ.mol-l
298K时,金属钙和氧气反应生成CaO固体的热化学方程式为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com