(2012?石家庄一模)某化学小组为测定某种铁的硫化物Fe
xS
y的组成,按照如下步骤进行了实验.
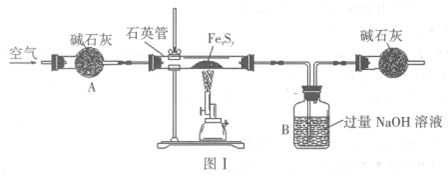
步骤一:利用图Ⅰ所示装置,高温灼烧4.16g Fe
xS
y至固体质量不再变化,得到红棕色固体和一种能使品红溶液褪色的气体.
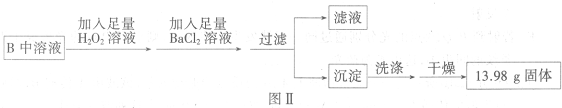
步骤二:将B中所得溶液按图Ⅱ进行处理.
请回答:
(1)步骤一中,当FexS
y固体完全反应后,还需继续通入空气片刻,其目的为
把生成的SO2气体全部吹入B中被NaOH溶液完全吸收;防止B中液体倒吸入硬质玻璃管中;
把生成的SO2气体全部吹入B中被NaOH溶液完全吸收;防止B中液体倒吸入硬质玻璃管中;
(2)加入H
2O
2溶液的作用为
SO32-+H2O2═SO42-+H2O
SO32-+H2O2═SO42-+H2O
(用离子方程式表示).
(3)过滤时用到的玻璃仪器除烧杯外,还有
漏斗、玻璃棒
漏斗、玻璃棒
(填仪器名称).
(4)判断步骤二中沉淀是否已经洗涤干净的操作方法为
取最后一次洗涤所得的溶液少许于试管中,滴加稀硫酸(硫酸钠或硝酸酸化的硝酸银溶液),若无白色沉淀生成,说明沉淀已洗涤干净;若有白色沉淀生成,说明沉淀未洗涤干净
取最后一次洗涤所得的溶液少许于试管中,滴加稀硫酸(硫酸钠或硝酸酸化的硝酸银溶液),若无白色沉淀生成,说明沉淀已洗涤干净;若有白色沉淀生成,说明沉淀未洗涤干净
.
(5)利用题中提供的数据可计算得出该铁的硫化物的化学式为
Fe2S3
Fe2S3
.
(6)实验过程中若无装置A,则所测Fe
xS
y中x:y的值将
偏小
偏小
(填“偏大”、“偏小”或“无影响”).
(7)某同学认为不用进行步骤二,只需通过测定步骤一中装置B中的溶液在反应前后的质量差,即可确定x:y的值.实验证明按此方法测定的结果偏小,其原因为
过量的氧气进入装置B中与SO32-反应生成SO42-,造成B中溶液在反应前后的质量差增大
过量的氧气进入装置B中与SO32-反应生成SO42-,造成B中溶液在反应前后的质量差增大
.





 备战中考寒假系列答案
备战中考寒假系列答案