
| A. | 电池工作时锌片作为正极 | |
| B. | 电池工作时从正极向外电路输出电子 | |
| C. | 电池工作时Mn02发生还原反应 | |
| D. | 电池工作时电能向化学能转化 |
分析 A、原电池中负极上发生失电子的氧化反应;
B、电池中电子从负极流向正极;
C、化合价升高元素发生氧化反应,化合价降低元素发生还原反应;
D、电池是将化学能转化为电能的装置.
解答 解:A、根据电池反应:Zn+2NH4C1+2Mn02═Zn( NH3)2C12+2MnO(OH),原电池中负极上是金属锌发生失电子的氧化反应,故A错误;
B、电池中电子从负极流向正极,故B错误;
C、电池工作时,Mn02中Mn的化合价降低,发生还原反应,故C正确;
D、电池是将化学能转化为电能的装置,故D错误.
故选C.
点评 本题考查了原电池原理,根据得失电子判断正负极及其反应,再结合离子移动方向、盐类水解来分析解答,难度不大.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
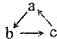 已知abc是中学常见的含有同种元素的三种物质,具有如图的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )
已知abc是中学常见的含有同种元素的三种物质,具有如图的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )| 选项 对应物质 | A | B | C | D |
| a | Cu(OH)2 | Na2O | Fe | Mg |
| b | CuCl2 | NaCl | FeCl3 | MgO |
| c | Cu | Na | FeCl2 | MgCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 现象或事实 | 解释 | |
| A | 进行中和热测定时,将NaOH溶液一次性快速倒入盛有H2SO4的量热计中 | 减少热量散失,减少测量误差 |
| B | 加热滴有酚酞试剂的纯碱溶液,溶液红色变深 | 加热促进水的电离,溶液的碱性增强 |
| C | 电解AlCl3水溶液,阴极周围出现白色胶状沉淀 | 生产的Al(OH)3胶体粒子带正电荷,发生定向移动 |
| D | 用FeCl3溶液制作印刷线路板 | FeCl3能从含有Cu2+的溶液中置换出Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | 增大压强能加快反应速率 | D. | N2与H2能100%转化为NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g N20含有的氮原子数目为NA | |
| B. | 常温常压下,22.4L N2含有的分子数目为NA | |
| C. | lmol Mg变为Mg2+时失去的电子数目为2NA | |
| D. | 1L lmol•L-1K2CO3,溶液中含有的钾离子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
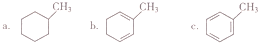
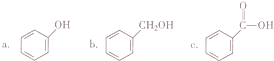
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产硫酸的过程中使用过量的空气,以提高二氧化硫的转化率 | |
| B. | 氯化镁溶液加热蒸干最终得不到氯化镁固体 | |
| C. | 实验室用排饱和食盐水的方法手机氯气 | |
| D. | 合成氨是放热反应,采用在较高温度下进行反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

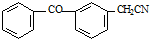 由C→D的反应类型是取代反应
由C→D的反应类型是取代反应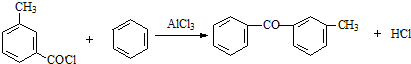

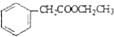 的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH
的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH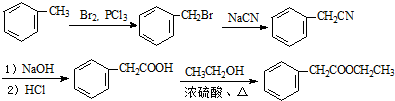 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com