
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
分析 (1)先计算每个时间段的气体体积,然后根据相同条件下,气体体积与反应速率的关系判断反应速率大小,根据该反应与能量变化的关系判断速率变化原因.
(2)先计算每个时间段的气体体积,然后根据相同条件下,气体体积与反应速率的关系判断反应速率大小,根据浓度与化学反应速率的关系判断速率变化的原因.
(3)先求出气体的物质的量,然后计算盐酸变化的物质的量,利用速率公式计算即可.
(4)根据浓度、电解质的强弱对反应速率的影响判断.
解答 解:0~1 min、1~2 min、2~3 min、3~4 min、4~5min,各时间段的气体体积分别为:50 mL、70mL、112 mL、58 mL、20 mL,
(1)、相同通条件下,反应速率越大,相同时间内收集的气体越多;过计算得,反应速率最大的时间段是2~3 min;原因是:该反应是放热反应,温度越高,反应速率越大.故答案为:2~3 min;
(2)相同通条件下,反应速率越小,相同时间内收集的气体越少;过计算得,反应速率最小的时间段是:4~5min;原因是:随着反应的进行,盐酸的浓度在减小,浓度越小,反应速率越慢.
故答案为:4~5min;
(3)2~3 min生成氢气的体积是112 mL,设需要盐酸的物质的量为xmol,
Zn+2HCl=ZnCl2 +H2 ↑
2mol 22.4L
xmol 0.112L
x=0.01 所以v(HCl )=$\frac{△n}{V△t}$=0.1mol/(L.min),
故答案为:0.1mol/(L.min);
(4)改变化学反应速率的方法有:改变溶液的浓度、改变溶液的温度、改变固体的表面积等.
A.加蒸馏水,溶液的体积增大,浓度降低,反应速率减小,但生成的气体的量不变,故A正确.
B.加NaCl溶液,溶液的体积增大,浓度降低,反应速率减小,但生成的气体的量不变,故B正确.
C.加Na2CO3溶液,溶液的体积增大,盐酸的浓度降低,但盐酸和碳酸钠反应生成二氧化碳,氢气的量减小,故C错误.
D.加CuSO4溶液,能形成铜锌原电池,加快反应速率,故D错误.
故选:AB.
点评 1、外界条件对化学反应速率的影响是次要因素,真正决定化学反应速率大小的是物质本身的性质.
2、考查了学生分析问题、解决问题的能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
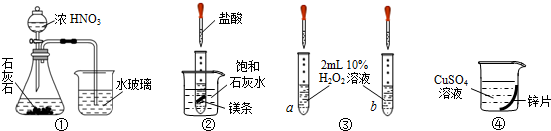
| A. | 实验①烧杯中出现白色胶状沉淀,证明非金属性:N>C>Si | |
| B. | 实验②烧杯中出现白色浑浊,说明镁与盐酸反应是放热反应 | |
| C. | 实验③a、b分别滴加2滴FeCl3溶液、CuSO4溶液,验证不同催化剂对反应速率的影响 | |
| D. | 实验④利用置换反应,证明金属单质还原性强弱,判断金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的还原性:K>Na>Mg>Al | |
| B. | 氢化物的稳定性:HCl<H2S<PH3<SiH4 | |
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO4 | |
| D. | 原子的氧化性:F>Cl>S>P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl、HCl、S | B. | 金刚石、Na3PO4、MgO | ||
| C. | HF、SiC、Ar | D. | H2O、SiO2、K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
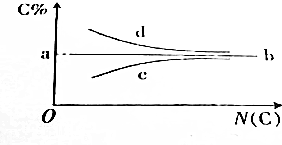
| A. | a点的值肯定是85.7% | B. | 满足b线走势的烃通式为CnH2n | ||
| C. | 满足c线走势的烃一定是烷烃 | D. | 满足d线走势的烃一定是炔烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com