
����Ŀ��������ɱ�ĺ�ѹ�ܱ������з�Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)����֪��ѹǿp�£��÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ����ƽ��ʱCO2��ת������ͼ��ʾ��������˵������ȷ���ǣ� ��
CH3OH(g)+H2O(g)����֪��ѹǿp�£��÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ����ƽ��ʱCO2��ת������ͼ��ʾ��������˵������ȷ���ǣ� ��
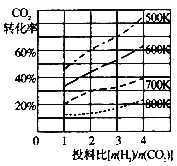
A���÷�Ӧ��S��0��H��0
B�����¶Ȳ��䣬��С��Ӧ��Ͷ�ϱ�[n(H2)/n(CO2)]��Kֵ����
C��700KͶ�ϱ�[n(H2)/n(CO2)] = 2ʱ����ƽ��ʱH2��ת����Ϊ45%
D��700Kʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��KP= ![]()
���𰸡�B
��������
���������A����Ϊ�¶�Խ�ߣ�CO2ת����ԽС����ƽ�����ƣ����Ը÷�Ӧ������Ϊ���ȷ�Ӧ�����ݷ���ʽ���÷�Ӧ�����ؼ�С�ķ�Ӧ����A��ȷ��B��Kֻ���¶�Ӱ�죬���¶Ȳ��䣬��СͶ�ϱȣ���K���䣬���¶Ȳ��䣬��С��Ӧ��Ͷ�ϱ�[n(H2)/n(CO2)]��Kֵ���䣬��B����C��700KͶ�ϱ�[n(H2)/n(CO2)] = 2ʱ������ͼ��ƽ��ʱCO2��ת����Ϊ30%����CO2�����ʵ���Ϊ1mol����Ӧ�����������ʵ���Ϊ0.9mol��������ת����Ϊ![]() ��100%=45%����C��ȷ��D��ƽ�ⳣ�������������Ũ����֮�����Է�Ӧ���Ũ����֮����������ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��KP=
��100%=45%����C��ȷ��D��ƽ�ⳣ�������������Ũ����֮�����Է�Ӧ���Ũ����֮����������ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��KP= ![]() ����D��ȷ����ѡB��
����D��ȷ����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ִ�����ˮ��ȼ�ϵ��ģ������ͼ��ʾ���õ�ع���ʱ��ֻ�����ˮע�뷴Ӧ�أ�ϸ���Ϳɽ���ˮ�е��л���ֽ⣬�ڴ˹������ͷų����ӡ����Ӻ��ҡ�������������ȷ����
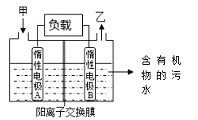
A. B�缫Ϊ����
B. �����ҿ���ΪCO2
C. O2��A�缫�õ���
D. ��ع���ʱ��B�缫������pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʽṹ�����ʡ�
�������İ�ˮ�ӵ�����ͭ��Һ�У���Һ���ձ������ɫ�����������Ҵ�����������ɫ�ľ��� [Cu��NH3��4]SO4��H2O��
��1��Cu��̬��������Ų�ʽΪ ��
[Cu��NH3��4]SO4��H2O�У���Cu2+�γ���λ����ԭ���� ����Ԫ�ط��ţ���
��2���Ҵ�������̼ԭ�ӹ���ӻ�����Ϊ ��
��H2O��Ϊ�ȵ������һ��������Ϊ ���ѧʽ����
��3��[Cu��NH3��4]SO4��H2O���� ��������ţ�
a�����Ӽ� b�����Թ��ۼ� c�������Թ��ۼ� d�������� e�����
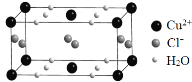
��4��ij���нᾧˮ��ͭ���Ȼ���ľ����ṹ��ͼ��ʾ���û�����Ļ�ѧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����б仯�������ȷ�Ӧ����______________(�����)��
���������������ڱ�������CO2������Ȼ����ȼ�գ������մ���ʯ����ϡ������ϡ��ˮ��ϣ�����ʯ����ˮ��Ӧ������ʯ�ң��ɱ���������������ˮ��Ӧ������ʯ�����Ȼ�茶���ķ�Ӧ
��2������ȼ������Һ̬ˮ���Ȼ�ѧ����ʽΪ2H2(g)��O2(g)===2H2O(l) ��H����572 kJ��mol��1����ش��������⣺
����2 mol������ȫȼ������ˮ��������ų�������______(����ڡ�����С�ڡ����ڡ�)572 kJ��
�ڷ�Ӧ2H2��O2==2H2O�������仯��ͼ��ʾ����֪��1 mol H2��1 mol O2��1 mol H��O�еĻ�ѧ���ֱ���Ҫ����436 kJ��496 kJ��463 kJ��������Ӧ����(��)___(����ա��ų���)___kJ������
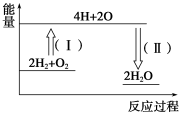
��3����֪��Ӧ2HI(g)==H2(g)��I2(g) ��H��+11 kJ��mol��1,1 mol H2(g)��1 mol I2(g)�����л�ѧ������ʱ�ֱ���Ҫ����436 kJ��151 kJ����������1 mol HI(g)�����л�ѧ������ʱ�����յ�����Ϊ____kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⡿������Ϊͬ��Ԫ�ء��ݱ������þ�γɵĻ�����ˢ�������������ﳬ�������¼����þ���仯�����ڹ�ũҵ������Ӧ�ù㷺�����ᣨH3BO3���Ǽ�����һԪ���ᡣ��þ����Ҫ�ɷ�ΪMg2B2O5��H2O������þ��̼立�ʵ�����Ʊ��������Ҫ�������£�
![]()
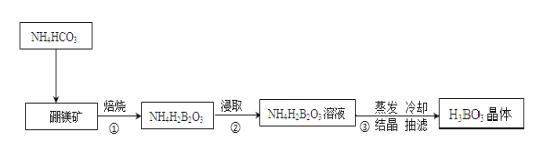
��ش�
��1����������ʵ������Ҫ����þ����� �����б��գ���ʵ����������
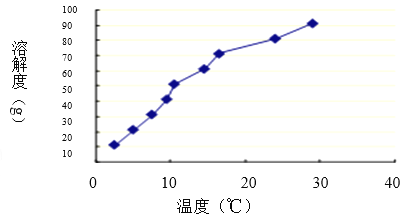
��2���������в��ü�ѹ���ˣ���С��ͬѧ���õ�װ������ͼ��ʾ����ʵ������з��ֵ�������Ӧ��ȡ���ʵ������� ����NH4H2BO3��Һ������ᾧ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����������ᾧ�壬����ʵ����������ʹ�õ������������нϴ�������� ��
A���ϸ��¶��¿�������
B���ñ�ˮ��ȴ NH4H2BO3��Һ
C�����ý�ϡ��NH4H2BO3��Һ
��3�������Ǽ�����һԪ���ᣬ�����ӷ���ʽ��ʾ������Һ�����Ե�ԭ�� �������ܽ������ͼ��ʾ���Ӳ������л��H3BO3������Ҫϴ�ӡ����ϴ�ӹ�������Ҫ�� �����ˮ������ˮ��������������� ��
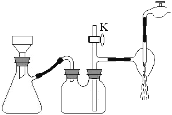
��4���ⶨ���ᾧ�崿�ȵ����鷽���ǣ�ȡ0��5000g��Ʒ����ƿ�У��μӸ��ͣ���ʹ��Ʒ�ܽ⣬Ѹ����ȴ�����£��μ�ָʾ������NaOH����Һ�ζ���15��80mlʱ�����յ㡣��֪��ÿ1��00mlNaOH�ζ�Һ�൱��30��92mg��H3BO3�������Ʒ��H3BO3����������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ�ķǽ���Ԫ�أ�������;֮һ����ȡ��������Ӧ����ʽΪ��
N2(g)+3H2(g)![]() 2NH3(g)���ش��������⣺
2NH3(g)���ش��������⣺
��1����Ԫ����Ԫ�����ڱ���λ��Ϊ______________��N2���ṹʽΪ______________
��2����һ���ݻ�Ϊ2L���ܱ�������������Ӧ����Ӧ��ʼʱ�������ʵ����ֱ�Ϊ��n(N2)=2mol��n(H2)=4mol��2min��n(H2)=1mol��
v��ʾ��Ӧ���ʣ�������ȷ����______________
A��2minĩʱn(NH3)=2.0molB��v(N2)=0.25mol��L��1��min��1
C��v(NH3)=1.0mol��L��1��min��1D��2minĩʱN2��Ũ��Ϊ0.5mol��L��1
��3����350�桢30MPa�ºϳɰ���ʱ��n(NH3)��n(H2)(n��ʾ���ʵ���)��ʱ��仯�Ĺ�ϵ����ͼ��ʾ��������ȷ����______________��
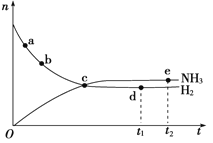
A����a������Ӧ���ʱȵ�b�Ĵ�
B����c����Ӧ�ﵽƽ��
C����d(t1ʱ��)�͵�e(t2ʱ��)��n(N2)��һ��
D�������������䣬��������ʵ���������ʹ�÷�Ӧ�ӿ�
��4���������γɶ������Ӻͷ��ӣ���N3-��NH2-��N2H4��N2H5+��N2H62+�ȣ���֪N2H5+��N2H62+�����Է���N2H4����������ɵģ�����NH4+���Ƶ����ʡ�
��д��N2H5+��ǿ�Ӧ�����ӷ���ʽΪ��______________��
���ڻ���ƽ�����װ�л�ԭ����(N2H4)��ǿ������H2O2�����߷�Ӧ�������ֲ���Ⱦ���������ʡ�д��N2H4����ʽ______________���÷�Ӧ�Ļ�ѧ����ʽΪ______________��
��д����N3-��������ȵ�һ�ַ��ӵķ���ʽ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��ѡ��3:���ʽṹ��ǰ������ԭ�������������������Ԫ�أ�A��B��C��D��E��H�У�AԪ���������к�����ḻ��BԪ�ػ�̬ԭ�ӵĺ�����3��������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ�����Ŀ��ͬ��DԪ���ǵؿ��к�������Ԫ�أ�EΪd��Ԫ�أ�����Χ�����Ų�����4�ԳɶԵ��ӣ�HԪ�ػ�̬ԭ�������ֻ��һ�����ӣ���������ѳ������ӡ�
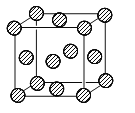
��1��EԪ�������ڱ��е�λ���� ��
��2������Ԫ���е縺������Ԫ��Ϊ ��ǰ����Ԫ���е�һ��������С��Ԫ��Ϊ______��дԪ�ط��ţ���CԪ����Ԫ�ط����γ�C2F2���ӣ��÷�����Cԭ�ӵ��ӻ���ʽ��____________��
��3�������E��BD��4������ΪҺ̬��������CCl4�������л��ܼ����ݴ��жϸ÷������� ���ӣ�����ԡ��Ǽ��ԡ������÷����ЦҼ���м���Ŀ��Ϊ ��
��4��H���ʵľ����ṹ��ͼ��ʾ����ԭ�Ӳ�ȡ�Ķѻ���ʽΪ ������֪Hԭ�Ӱ뾶Ϊr pm ��NA��ʾ����٤��������Ħ������ΪM������Ӧ��ĸ��ʾ��
�ٸ�ԭ�ӵ���λ��Ϊ ��
�ڸþ�����ܶ�Ϊ g/cm3��
��Hԭ�Ӳ�ȡ���ֶѻ���ʽ�Ŀռ�������Ϊ (�ú��б���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ﮡ�ͭ����ȼ�ϵ�������ߡ��ɱ��ͣ����й����ķ�չǰ�����õ��ͨ��һ�ָ��ӵ�ͭ��ʴ�����������ܣ����зŵ����Ϊ2Li+Cu2O+H2O��2Cu+2Li��+2OH��������˵������ȷ����

A���ŵ�ʱ��Li��������������Cu���ƶ�
B���ŵ�ʱ�������ĵ缫��ӦʽΪO2+2H2O+4e����4OH��
C��ͨ����ʱ��ͭ����ʴ���������Cu2O
D��������Ӧ�����У�������ΪO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л���ѧ����������֪��![]() (��Ҫ����)��1 molij��A���ȼ�պ���Եõ�8 mol CO2��4 mol H2O������A�ڲ�ͬ�������ܷ���������ʾ��һϵ�б仯��
(��Ҫ����)��1 molij��A���ȼ�պ���Եõ�8 mol CO2��4 mol H2O������A�ڲ�ͬ�������ܷ���������ʾ��һϵ�б仯��
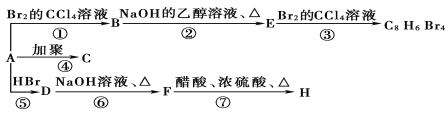
��1��A�Ļ�ѧʽ�� ��A�Ľṹ��ʽ�� ��
��2��������Ӧ�У�����________��Ӧ������________��Ӧ��(�Ӧ����)
��3��д��C��D��E���ʵĽṹ��ʽ��
C ��D ��E
��4��д��D��F��Ӧ�Ļ�ѧ����ʽ ��F ����ܡ����ܡ�����Cu��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com